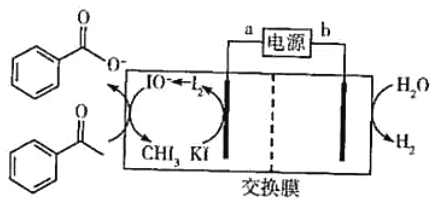
题目内容
【题目】环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为![]() ],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法正确的是( )
],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法正确的是( )
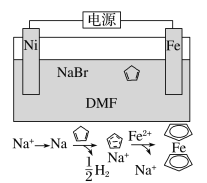
A.该电池工作是,镍连接的是电源的正极
B.可将该电池的DMF惰性有机溶剂更换为NaOH溶液
C.该反应的总反应方程式为Fe+2![]() +H2↑
+H2↑
D.溶液中的Na+离子不断的向Fe附近移动
【答案】C
【解析】
由制备流程可知,Fe失去电子生成Fe2+,Na+得到电子生成Na,所以阳极为Fe电极,Na是中间产物,不参与反应,反应物为Fe和C5H6,生成物为H2和Fe(C5H5)2,因此反应方程式为:Fe+2C5H6= Fe(C5H5)2+ H2↑。
A. Fe失去电子生成Fe2+,阳极为Fe电极,Fe电极与电源的正极相连,A错误;
B. 水会阻碍中间产物Na的生成,且OH-会与Fe2+反应生成Fe(OH)2,所以DMF惰性有机溶剂不能更换为NaOH溶液,B错误;
C. Na是中间产物,不参与反应,反应物为Fe和C5H6,生成物为H2和Fe(C5H5)2,因此反应方程式为:Fe+2![]() +H2↑,C正确;
+H2↑,C正确;
D. 电解池中阳离子移向阴极,阴离子移向阳极,溶液中的Na+离子不断的向Ni附近移动,D错误;
故答案为:C。

练习册系列答案
相关题目
【题目】下列事实与原因对应关系不正确的是
A | B | C | D | |
物质 |
Na2FeO4 |
海水稻 |
金属铜 |
碳酸钠 |
事实 | 用于自来水净水消毒 | 海水稻的秸杆可以燃烧发电 | Cu作原电池的电极 | 制革工业中原料皮的脱脂 |
主要原因 | Na2FeO4有强氧化性且能在水中产生胶体 | 稻子的秸杆中蕴含生物质能 | Cu能导电且质稳定 | Na2CO3稳定性强 |
A.AB.BC.CD.D