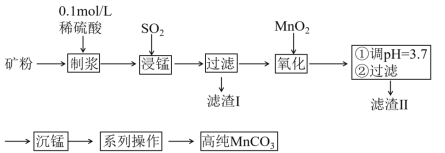
题目内容
【题目】《Journal of Energy Chemistry》报导我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A.c为电源的负极
B.a极的电极反应式为:2C2O52- -4e- =4CO2 ↑+O2↑
C.①②中,捕获CO2时碳元素的化合价均未发生变化
D.转移l mol电子可捕获CO2 11.2 L(标况下)
【答案】D
【解析】
A. d电极上CO32-→C,得到电子,发生还原反应,所以d为阴极,则c为电源的负极,A正确;
B. a电极上C2O52-→O2,失去电子发生氧化反应,所以a为阳极,电极反应式为2C2O52- -4e- =4CO2 ↑+O2↑,B正确;
C. ①中CO2→C2O52-或②CO2→CO32-时C元素化合价均为+4价,所以C元素化合价均没有发生变化,C正确;
D. 根据图示a极生成O2,d极生成C,故该装置中总反应为CO2![]() C+O2,每捕获1molCO2转移4 mol电子,则每转移1mol电子捕获0.25molCO2,其在标准状况下体积为5.6L,D错误;
C+O2,每捕获1molCO2转移4 mol电子,则每转移1mol电子捕获0.25molCO2,其在标准状况下体积为5.6L,D错误;
故答案选D。

练习册系列答案
相关题目
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
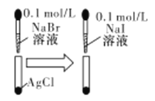
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D