题目内容
已知热化学方程式:2SO2(g)+O2(g) 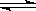 2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
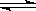 2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是| A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2 mol SO2(g)被氧化 |
D
A 错误,此反应是放热反应,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量
B 错误,此反应是可逆反应,2 mol SO2(g)和1 mol O2(g)未反应彻底,放出热量小于Q kJ
C 错误,增大压强平衡右移
D 正确,当反应放热Q kJ时,肯定有2mol SO2(g)参加反应,即被氧化。
B 错误,此反应是可逆反应,2 mol SO2(g)和1 mol O2(g)未反应彻底,放出热量小于Q kJ
C 错误,增大压强平衡右移
D 正确,当反应放热Q kJ时,肯定有2mol SO2(g)参加反应,即被氧化。

练习册系列答案
相关题目
 2C(g)△H=-a kJ·mol-1(a>0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出akJ的热量
2C(g)△H=-a kJ·mol-1(a>0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出akJ的热量