��Ŀ����
����Ŀ���ơ�þ�����ĵ��ʼ��仯��������ѧ���ص���峵����.
(1)�����ʷ��࣬Na2O2____________(����������������������)���������
(2)�����ӷ���ʽ˵��Al(OH)3������������� ____________________��
(3)ijͬѧ����ͼ��ʾװ�ý���ʵ��̽���й��ơ�þ�����Ļ����������(�г�����ʡ��)����Һ��A�������뵽����B�У��ش��������⣺
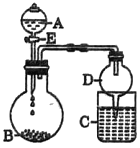
����AΪ70%������Һ��BΪNa2SO3��Cʢ��������(H2S)������Һ������E��C�з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
����AΪˮ��BΪMg3N2��C��ʢ��AlC13��Һ������E���㹻����ʱ���C�з�����Ӧ�����ӷ���ʽΪ__________________________��
����AΪŨ���ᣬBΪNaClO3��C��ʢ��KI-������Һ������E��C�е�������________________������ͨ������C�У��㹻����ʱ�����C����Һ����ɫ��ʧ��������Ϊ����Һ��I2�ܱ�Cl2����ΪHIO3��д���÷�Ӧ�Ļ�ѧ����ʽ�� _______________��
���𰸡������� Al(OH)3+OH-=AlO2-+2H2O��Al(OH)3+3H+=Al3++3H2O 2H2S+SO2=3S��+2H2O Al3++3NH3��H2O=Al(OH)3��+3NH4+ ��Һ����ɫ�����ɫ 6H2O+I2+5Cl2=2HIO3+10HCl
��������
(1)���ݹ���������ˮ��Ӧ��������жϣ�
(2)�ܹ���Ӧ�����κ�ˮ��Ҳ�����ᷴӦ�����κ�ˮ�������������
(3)��������Na2SO3������Ӧ����SO2��SO2��H2S����Һ�з�����Ӧ����S���ʺ�ˮ�����ݵ����غ㡢ԭ���غ���д����ʽ��
��Mg3N2��ˮ������Ӧ����������þ�Ͱ�������������Һ����AlC13��Ӧ�������������������Ȼ�泥�
��Ũ������NaClO3����������ԭ��Ӧ����Cl2��������KI����ΪI2��I2��������Һ��Ϊ��ɫ�������������������������ὫI2����ΪHIO3��C����Һ����ɫ������������ԭ��Ӧ������д��Ӧ����ʽ��
(1)�������������������ᷴӦ�����κ�ˮ��������,����������ˮ��Ӧ����NaOH��O2����Ӧ����������⣬�����������ɣ���˹������Ʋ��Ǽ��������
(2)Al(OH)3�ǽ�����������ܹ���Ӧ�����κ�ˮ��˵�������������ʣ�Al(OH)3��ǿ��NaOH��Ӧ�����ӷ���ʽΪ��Al(OH)3+OH-=AlO2-+2H2O����ǿ��HCl��Ӧ�����Ȼ�����ˮ��˵������м�����ʣ��÷�Ӧ�����ӷ���ʽΪAl(OH)3+3H+=Al3++3H2O��
(3)��������Na2SO3������Ӧ����SO2����Ӧ����ʽΪH2SO4+Na2SO3=Na2SO4+SO2��+H2O��SO2��H2S����Һ�з�����Ӧ����������ˮ�ĵ���S��ˮ���÷�Ӧ�����ӷ���ʽΪ��2H2S+SO2=3S��+2H2O��
��Mg3N2��ˮ������Ӧ����������þ�Ͱ�������������ˮ�õ�һˮ�ϰ�������Һ��һˮ�ϰ���AlC13��Ӧ�������������������Ȼ�泥����C�з�����Ӧ�����ӷ���ʽΪAl3++3NH3��H2O=Al(OH)3��+3NH4+��
��Ũ������NaClO3����������ԭ��Ӧ����Cl2����Ӧ����ʽΪ6HCl(Ũ)+ NaClO3=NaCl+3Cl2��+3H2O����Ӧ��������������Һ��KI����ΪI2��I2��������Һ��Ϊ��ɫ����˿���C����Һ��Ϊ��ɫ������ͨ������C�У��㹻����ʱ����������������������������ὫI2����ΪHIO3����Һ����I2������ֿ���C����Һ����ɫ������������ԭ��Ӧ�е��ӵ�ʧ��Ŀ��ȣ��ɵø÷�Ӧ�Ļ�ѧ����ʽΪ��6H2O+I2+5Cl2=2HIO3+10HCl��

 53������ϵ�д�
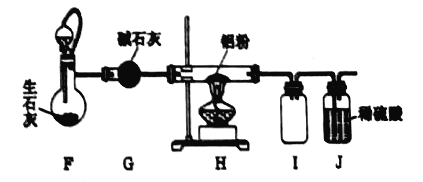
53������ϵ�д�����Ŀ���ҹ����зḻ�������Դ���༰�仯���ﱻ�㷺Ӧ���ڻ�е���ϡ����ϡ���ȼ�������Ӽ�����������ʮ����Ҫ�ļ�ֵ�����ô���Ǧ�ྫ����Ҫ�ɷ���Sb2S3��PbS���Ʊ���ף�Sb2O3���Ĺ���������ͼ��ʾ��
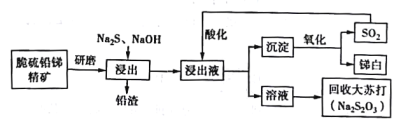
��֪��������ӦSb2S3+3Na2S = 2Na3SbS3
�ữ��Ӧ4Na3SbS3 +9SO2=6Na2S2O3+3S��+2Sb2S3��
�ش��������⡣
(1)���������ĥ��Ŀ����___________________��
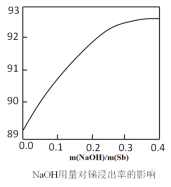
(2)�ڽ�����Ӧ�У���������NaOH�����ı仯������ͼ��ʾ������NaOH��������_______________________��
(3)�����Һ��ͨ��SO2��������ữ���õ�Sb2S3�м��塣�ữ��Ӧ�����У�pH��������ʼ��ữ����Һ��Na2S2O3������Ӱ�����±���ʾ���������˵�pHΪ__________�� pH���ܹ��͵�ԭ����_______________��������ӷ���ʽ˵������
pH | �ữ����Һ�ɷ�/��g��L-1�� | ��ij�����/% | |
Sb | Na2S2O3 | ||
6 | 0.6 | 160.5 | 99.5 |
7 | 2.7 | 157.6 | 97.5 |
8 | 5.6 | 150.4 | 95.4 |
9 | 10.5 | 145.0 | 92.4 |
(4)����Һ�ữ����ˣ��õ����������ڸ����±�������д�����з�Ӧ�Ļ�ѧ����ʽ��_____________��
(5)��β�������ĽǶ����۸ù��������ڻ���������ŵ���__________________��