题目内容
【题目】某化学实验小组为了探究氨气的氧化性设计了如下实验方案。
已知:①铝可以与氨气反应2Al+2NH3![]() 2AlN+3H2;
2AlN+3H2;
②氮化铝性质稳定,基本不与水、酸反应,在加热时溶于浓碱,可产生氨气。
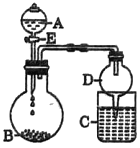
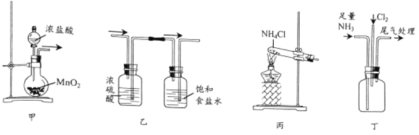
(1)上图是实验室制备氨气的常用发生装置,若选择装置b,则该发生装置中的化学反应方程式为:___________________________。
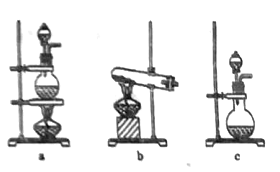
(2)若将装置c改进,按下图所示连接好装置,检査装置气密性;在蒸馏烧瓶中加入生石灰,分液漏斗中加入浓氨水,装置G中盛装碱石灰,装置H中加入铝粉。打开装置F处分液漏斗活塞,待装置中空气排尽后,再点燃装罝H处酒精灯。
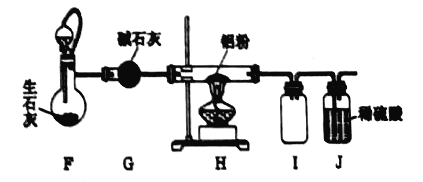
①装置F与装置c相比的优点: ____________________________。
②用平衡移动原理解释装置F中产生氨气的原因: __________________________。
③为了得到纯净的氮化铝,可将装置H中固体冷却后转移至烧杯中,加入_______溶解、__________(填操作名称)、洗涤、干燥即可。
④氮化铝与氢氧化钠溶液共热反应的离子方程式: __________________________。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 平衡气压,便于氨水顺利滴下 生石灰与水反应放热,降低了氨气的溶解度,使一水合氨分解,生石灰与水反应将溶剂消耗,产生的碱电离产生OH-,使溶液中c(OH-)增大,导致使平衡NH3+H2O
CaCl2+2NH3↑+2H2O 平衡气压,便于氨水顺利滴下 生石灰与水反应放热,降低了氨气的溶解度,使一水合氨分解,生石灰与水反应将溶剂消耗,产生的碱电离产生OH-,使溶液中c(OH-)增大,导致使平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-逆向移动,有利于氨气逸出。 稀盐酸(或稀硫酸) 过滤 AlN+OH-+H2O
NH4++OH-逆向移动,有利于氨气逸出。 稀盐酸(或稀硫酸) 过滤 AlN+OH-+H2O![]() A1O2-+NH3↑
A1O2-+NH3↑
【解析】
(1)该装置适用于固体混合物加热制取气体;
(2)①装置F与装置c相比,分液漏斗上下相连接,起连通器的作用;
②氨水中的一水合氨是一元弱碱,在溶液中存在电离平衡和分解平衡,根据离子浓度对平衡的影响分析;
③利用氮化铝性质稳定,基本不与水、酸反应的性质分析解答;
④氮化铝与氢氧化钠溶液共热产生氨气和偏铝酸钠。
(1)装置b适用于固体混合物加热制取气体,在实验室中一般是用铵盐与熟石灰混合加热制取氨气,反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)①根据装置图可知:装置F用橡胶管将分液漏斗上下连接起来,起连通器的作用,液体上下气体压强一致,这样打开分液漏斗活塞时,液体在重力作用下就可以顺利滴下,所以装置F与装置c相比的优点是平衡气压,便于氨水顺利滴下;
②将F处的氨水滴下,蒸馏烧瓶中的生石灰与水反应产生Ca(OH)2,反应放热,降低了氨气的溶解度,使一水合氨分解放出氨气,且生石灰与水反应将溶剂水消耗,反应产生OH-,使溶液中c(OH-)增大,平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-逆向移动,也有利于氨气逸出;
NH4++OH-逆向移动,也有利于氨气逸出;
③为了得到纯净的氮化铝,可将装置H中固体冷却后转移至烧杯中,加入稀盐酸溶解、过滤、洗涤、干燥即可。
④氮化铝与氢氧化钠溶液共热反应产生氨气和偏铝酸钠,反应的离子方程式为:AlN+OH-+H2O![]() A1O2-+NH3↑。
A1O2-+NH3↑。