题目内容
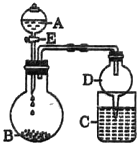
【题目】我国具有丰富的锑矿资源,锑及其化合物被广泛应用于机械材料、塑料、阻燃剂、微电子技术等领域,具有十分重要的价值。利用脆硫铅锑精矿(主要成分是Sb2S3及PbS)制备锑白(Sb2O3)的工艺流程如图所示。

已知:浸出反应Sb2S3+3Na2S = 2Na3SbS3
酸化反应4Na3SbS3 +9SO2=6Na2S2O3+3S↓+2Sb2S3↓
回答下列问题。
(1)精矿进行研磨的目的是___________________。
(2)在浸出反应中,浸出率随NaOH用量的变化曲线如图所示,其中NaOH的作用是_______________________。

(3)向浸出液中通入SO2气体进行酸化,得到Sb2S3中间体。酸化反应过程中,pH对锑沉淀率及酸化后溶液中Na2S2O3含量的影响如下表所示,则最适宜的pH为__________。 pH不能过低的原因是_______________(结合离子方程式说明)。
pH | 酸化后溶液成分/(g·L-1) | 锑的沉淀率/% | |
Sb | Na2S2O3 | ||
6 | 0.6 | 160.5 | 99.5 |
7 | 2.7 | 157.6 | 97.5 |
8 | 5.6 | 150.4 | 95.4 |
9 | 10.5 | 145.0 | 92.4 |
(4)浸出液酸化后过滤,得到沉淀混合物,在高温下被氧化,写出所有反应的化学方程式:_____________。
(5)从尾气处理的角度评价该工艺流程在环保方面的优点是__________________。
【答案】增大反应物的接触面积,加快反应速率,提高浸出率 提供碱性环境,减少Na2S的水解 6 pH较低时发生反应S2O32-+2H+=S↓+SO2↑+H2O,会造成Na2S2O3损耗 2Sb2S3+9O2![]() 2Sb2O3+6SO2,S+O2
2Sb2O3+6SO2,S+O2![]() SO2 SO2可以循环利用,减少环境污染
SO2 SO2可以循环利用,减少环境污染
【解析】
(1)将精矿进行研磨有助于增加反应的接触面积,加快反应速率,提高Sb的浸出率;
(2)浸出时加入Na2S溶液中的S2-会发生水解,当加入NaOH时,溶液呈碱性,可以抑制S2-的水解;
(3)从表中可以看出,当pH=6时,溶液中的Sb含量最少,沉淀率最大,故最适宜的pH选择6;如果pH过低,酸化后生成的S2O32-可以与溶液中的H+反应生成S沉淀,影响Na2S2O3的产率。
(4)酸化后的沉淀为Sb2S3和S的混合物,在高温下与氧气发生反应生成SO2和Sb2O3,相应的反应方程式为2Sb2S3+9O2![]() 2Sb2O3+6SO2,S+O2
2Sb2O3+6SO2,S+O2![]() SO2;
SO2;
(5)沉淀氧化后有SO2气体生成,将气体通入到酸化溶液中循环利用可以减少环境污染。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案