题目内容
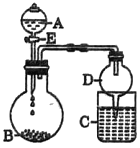
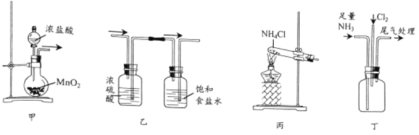
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )
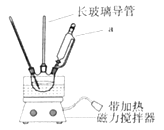
A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
【答案】C
【解析】
A.根据仪器装置图可知,仪器a是恒压滴液漏斗,故A不符合题意;
B.加热条件下,苯、浓硝酸均易挥发,因此长玻璃导管可起到平衡装置内外气压以及冷凝回流的作用,故B不符合题意;
C.浓硫酸密度较大,且溶解过程中放出大量热,因此不能先加入浓硫酸,应在浓硝酸中加入浓硫酸,冷却后滴入苯,其目的是:一方面两酸混合产生大量的热,使混合酸的温度升高,一部分浓硝酸将分解;另一方面,苯的沸点比较低,大量的苯将蒸发掉,影响硝基苯的产率,故C符合题意;
D.苯和硝基苯不易溶于水中,因此产品可先进行分液,分离出苯和硝基苯的有机层,然后利用蒸馏有机物分离出硝基苯,故D不符合题意;
故答案为:C。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中6种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 单质是稳定的半导体材料,用于制造芯片 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色反应为紫色(透过蓝色钴玻璃片) |
Z | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
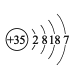
M | 原子结构示意图为 |
(1)Q元素所在周期表的位置为_____。
(2)W单质的电子式为_____。
(3)Z的单质与X的最高价氧化物对应的水化物反应的离子方程式为_____。
(4)Y的金属性强于X,请结合原子结构解释其原因_____。
(5)下列对于M及其化合物的推断中,正确的是_____(填序号)。
①M的最低负化合价与W的最低负化合价相同
②M的氢化物的稳定性弱于W的氢化物的稳定性
③M的单质可与X和W形成的化合物的水溶液发生置换反应
(6)与M位于同一主族,电子层数比M多一层的元素在生活中的用途是_____(写出一条即可)。