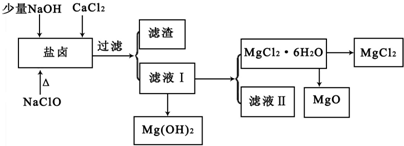
题目内容
9.下列有关钠的叙述中,错误的是( )| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠极易和水反应而被还原 | |
| D. | 钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
分析 A.钠比较活泼,可用来置换较难冶炼的较不活泼金属;
B.钠的化学性质非常活泼,易失去最外层电子而被氧化生成化合物;
C.钠和水反应失电子体现还原性;
D.焰色反应是元素的性质,无论元素处于什么样的状态都有同样的焰色;
解答 解:A.钠比钛、锆、铌等金属活泼,并且钛、锆、铌等金属较难冶炼,可用钠置换,故A正确;
B.钠的化学性质非常活泼,易失去最外层电子而被氧化生成化合物,在自然界中只能以化合态存在,故B正确,
C.钠极易和水反应失电子而被氧化,故C错误;
D.焰色反应是元素的性质,无论元素处于什么样的状态都有同样的焰色,所以钠、氧化钠、氢氧化钠的焰色反应均显黄色,故D正确.
故选C.
点评 本题考查钠的性质,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
19.短周期元素X、Y、Z在周期表中的位置如表所示,下列叙述不正确的是( )
| X | ||
| Y | ||
| Z |
| A. | X是活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是最活泼的非金属元素,不存在最高价氧化物的水化物 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | X、Y、Z的单质中Z的熔点最高 |
20.四种短周期元素在表中位置如图,有关说法正确的是( )
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
14.下列有关化学用语表示正确的是( )
| A. | Na2O2的电子式为 Na${\;}_{•}^{•}$$\stackrel{••}{O}$${\;}_{•}^{•}$${\;}_{•}^{•}$$\stackrel{••}{O}$${\;}_{•}^{•}$Na | |
| B. | NH4Br的电子式: +Br- +Br- | |
| C. | 氢氧根离子的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | |
| D. | HClO的电子式:H${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
19.铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见上表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
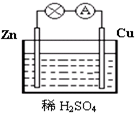 图为原电池的示意图.请回答:
图为原电池的示意图.请回答: