题目内容
1.在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-=Zn2+,锌片上观察到的现象为逐渐溶解,质量减小银为正极,电极上发生的是还原反应(“氧化”或“还原”),银片上观察到的现象是析出红色的金属.分析 铜锌原电池中,较为活泼的金属锌为原电池的负极,发生氧化反应,正极为较不活泼的铜,发生还原反应,根据金属的性质和电解质溶液书写电极反应式.
解答 解:银锌原电池中,较为活泼的金属锌为原电池的负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,负极逐渐溶解,质量减小,正极为较不活泼的银,发生还原反应,铜离子在正极上得电子生成铜,电极反应为,Cu2++2e-=Cu,现象是析出红色的金属,
故答案为:负;氧化;Zn-2e-=Zn2+;逐渐溶解,质量减小;正;还原;析出红色的金属.
点评 本题考查了原电池原理,为高频考点,明确原电池中正负极上得失电子及发生的反应即可解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.以下化学用语正确的是( )
| A. | 苯的实验式 C6H6 | B. | 乙醇的分子式CH3CH2OH | ||
| C. | 乙烯的结构简式CH2CH2 | D. | 甲醛的结构式: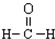 |
9.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠极易和水反应而被还原 | |
| D. | 钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
16.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:d>c>b>a | B. | 原子半径:r(A)>r(B)>r(D)>r(C) | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) |
6.决定粒子是否为同一种元素的是( )
| A. | 粒子内所具有的质子数 | B. | 原子核内的质子数 | ||
| C. | 原子或单核离子的质量数 | D. | 原子核外的电子数 |
13.在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是( )
| A. | N2 | B. | PCl3 | C. | PCl5 | D. | CO2 |
10.已知:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,下列说法正确的是(设NA为阿伏加德罗常数的值)( )
| A. | 氯气是氧化剂,FeCl3是还原剂 | |
| B. | 常温下,与56g Fe反应断裂1.5NA个Cl-Cl键 | |
| C. | 1 L 0.1 mol•L-1 FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 常温常压下,22.4 L Cl2和足量Fe反应转移3NA个电子 |
11.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热量.据此试判断下列结论正确的是( )
| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 1mol石墨比1mol金刚石的总能量低 | D. | 1mol石墨比1mol金刚石的总能量高 |
 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.