��Ŀ����
4����±�г�����Mg2+��Cl-�⣬����������Na+��Fe2+��Fe3+��SO42-��CO��NH2��2�ȣ��Ӻ�ˮ��ȡʳ�κ�Br2�����±�п�����ȡMgCl2��MgO��Mg��OH��2�����ʣ��Ʊ�������ͼ��ʾ��
��1����MgCl2��Һ�õ�MgCl2.6H2O����Ĺ���������Ļ�������˳������ΪBCE
A����������B������Ũ��C����ȴ�ᾧD�����ȹ��� E������ϴ��
��2����ȡ��ˮ�Ȼ�þ�������Ȼ�����ڵ������½��У�ԭ���ǣ���ֹMg2+ˮ�⣬Mg2++2H2O?Mg��OH��2+2H+�����ʵ������ֽ�ϻ�ѧ����˵����
��3����NaClO��ȥ����CO��NH2��2ʱ������������⣬�����ܲ������ѭ�������ʣ���÷�Ӧ�Ļ�ѧ����ʽΪ3NaClO+CO��NH2��2�T3NaCl+CO2��+N2��+2H2O��NaOH+3NaClO+CO��NH2��2�T3NaCl+NaHCO3+N2��+2H2O������NaClO����һ�������ǽ�Fe2+����ΪFe3+�����γ�Fe��OH��3����ȥ
��4��Mg��OH��2����þ�Ρ��ͻ���Ϻ���ȼ������Ҫԭ�ϣ�
��֪25��ʱKsp[Mg��OH��2]=5.6��10-12����Mg��OH��2��s���TMgO��s��+H2O��s����H=+81.5kJ/mol��
������������ȷ����B
A������±��ˮ�л��Mg��OH��2����ҵ��ѡ��NaOH��������
B��Mg��OH��2������ȼ����ԭ�������ֽ�����������MgO���ǿ�ȼ��
C���ɼ���Mg��OH��2�õ�MgO���ٵ�����ڵ�MgO�ƽ���þ
�����ָʾ�����������ɫ��pH��Χ���£�
| pH | ��8.0 | 8.0��9.6 | ��9.6 |
| ��ɫ | ��ɫ | ��ɫ | ��ɫ |
���� ����±��Һ�м���NaClO��NaClO����ǿ�����ԣ��ܽ�Fe2+����ΪFe3+������±�м�������NaOH��NaOH��Fe3+��Ӧ����Fe��OH��3��CO��NH2��2��NaClO����������ԭ��Ӧ������������⣬�����ܲ������ѭ�������ʣ�������������NaCl��CO2��N2��H2O������������̼�ܺ�NaOH��Ӧ����̼�����ƣ�����Һ���˵õ���������Fe��OH��3����ҺI�к���Mg2+��Cl-��Na+������ҺI�������ᾧ�����˵õ�MgCl2•6H2O������Һ�к��е�����������Na+��ֱ�ӽ�MgCl2•6H2O��ǿ���ܵõ�MgO��������ӦMgCl2•6H2O$\frac{\underline{\;\;��\;\;}}{\;}$MgO+2HCl��+5H2O�����Ȼ�þ��ˮ�⣬���Բ����ü���MgCl2•6H2O������ȡ�Ȼ�þ��Ҫ��HCl��Χ����ȡ�Ȼ�þ��
��1����Һ�еõ����ʾ���ķ����Ǽ���Ũ������ȴ�ᾧ������ϴ�ӣ�
��2��þ������ˮ��Һ����ˮ������������þ������
��3����NaClO��ȥ����CO��NH2��2ʱ������������⣬�����ܲ������ѭ�������ʣ��жϷ�Ӧ�����Ȼ��ơ�������������̼��ˮ���������ƾ���ǿ�����ԣ��ܽ�������������Ϊ�����ӣ�
��4����A������±��ˮ�л��Mg��OH��2����ҵ��ѡ����ʯ������������
B��Mg��OH��2�ֽ����ȣ���MgO����ȼ�գ�
C��MgO�۵�̫�ߣ���ҵ�ϵ���Ȼ�þ��ȡþ��
��Mg��OH��2�ı�����Һ�е��ܶȻ����㱥����Һ�е�����������Ũ�ȣ����ˮ��Һ�����ӻ�����������Ũ�ȼ���pH��Ȼ���ϱ��������ж���Һ�����ֵ���ɫ��
��� �⣺����±��Һ�м���NaClO��NaClO����ǿ�����ԣ��ܽ�Fe2+����ΪFe3+������±�м�������NaOH��NaOH��Fe3+��Ӧ����Fe��OH��3��CO��NH2��2��NaClO����������ԭ��Ӧ������������⣬�����ܲ������ѭ�������ʣ�������������NaCl��CO2��N2��H2O������������̼�ܺ�NaOH��Ӧ����̼�����ƣ�����Һ���˵õ���������Fe��OH��3����ҺI�к���Mg2+��Cl-��Na+������ҺI�������ᾧ�����˵õ�MgCl2•6H2O������Һ�к��е�����������Na+��ֱ�ӽ�MgCl2•6H2O��ǿ���ܵõ�MgO��������ӦMgCl2•6H2O$\frac{\underline{\;\;��\;\;}}{\;}$MgO+2HCl��+5H2O�����Ȼ�þ��ˮ�⣬���Բ����ü���MgCl2•6H2O������ȡ�Ȼ�þ��Ҫ��HCl��Χ����ȡ�Ȼ�þ��
��1����MgCl2��Һ�õ�MgCl2.6H2O����Ĺ��̣�����Ũ������ȴ�ᾧ������ϴ�ӣ�����ѡ��BCE��
�ʴ�Ϊ��BCE��
��2��ֱ�ӽ�MgCl2•6H2O��ǿ���ܵõ�MgO��ͬʱ������HCl��ˮ��������Ӧ����ʽΪMgCl2•6H2O$\frac{\underline{\;\;��\;\;}}{\;}$MgO+2HCl��+5H2O�����Ȼ�þ��ˮ�⣬Ϊ��ֹ�Ȼ�þˮ�⣬����ȡ�Ȼ�þʱ��Ҫ��MgCl2•6H2O�����Ȼ��������У���ֹMg2+ˮ�⣬Mg2++2H2O?Mg��OH��2+2H+��
�ʴ�Ϊ����ֹMg2+ˮ�⣬Mg2++2H2O?Mg��OH��2+2H+��
��3��ͨ�����Ϸ���֪���÷�ӦΪ3NaClO+CO��NH2��2�T3NaCl+CO2��+N2��+2H2O��NaOH+3NaClO+CO��NH2��2�T3NaCl+NaHCO3+N2��+2H2O���������ƾ���ǿ�����ԣ��ܽ�������������Ϊ�����ӣ���ת��Ϊ����������������ȥ��
�ʴ�Ϊ��3NaClO+CO��NH2��2�T3NaCl+CO2��+N2��+2H2O��NaOH+3NaClO+CO��NH2��2�T3NaCl+NaHCO3+N2��+2H2O������Fe2+ʹ�����Fe��OH��3��������ȥ��
��4����A������±��ˮ�л��Mg��OH��2����ҵ��ѡ����ʯ��������������A����
B��Mg��OH��2�ֽ����ȣ���MgO����ȼ�գ�����Mg��OH��2������ȼ�������ֽ�����������MgO���ǿ�ȼ���B��ȷ��
C��MgO�۵�̫�ߣ���ҵ�ϵ���Ȼ�þ��ȡþ����C����
�ʴ�Ϊ��B��
��25��ʱ��Mg��OH��2���ܶȻ�Ksp=5.6��10-12�����ݷ�ӦMg��OH��2��s��?Mg2++2OH-�ɵã�c��Mg2+��•c2��OH-��=5.6��10-12��
��c��OH-��=2c��Mg2+��=x����0.5x��x2=5.6��10-12��
��ã�x=2.24��10-4mol/L��
c��H+��=$\frac{1{0}^{-14}}{2.24��1{0}^{-4}}$mol/L=4.5��10-11mol/L��
��Һ��pH=10.4��9.6��������Һ����ɫ��
�ʴ�Ϊ����ɫ��
���� ���⿼��������ˮ�⡢��Ӧ��ѧ��Ӧ�Է����е���������ѧʵ������������ۺ�Ӧ�õ�֪ʶ���Ѷ��еȣ������漰��֪ʶ��϶࣬ȫ�濼����ѧ���ķ�����������������ȷ������������Ϊ���ؼ����ѶȽϴ�

| A�� | Ԫ�صĻ��ϼ۵������Ա仯 | |
| B�� | Ԫ��ԭ�ӵ�ԭ�Ӱ뾶�������Ա仯 | |
| C�� | Ԫ��ԭ�ӵĺ�������Ų��������Ա仯 | |
| D�� | Ԫ��ԭ�ӵĵ��Ӳ����������Ա仯 |
| A�� | �ƵĻ�ԭ�Ժ�ǿ����������ұ�������ѡ�ﯡ���� | |
| B�� | �ƵĻ�ѧ���ʷdz����ã���Ԫ��ֻ���Ի���̬��������Ȼ�� | |
| C�� | �Ƽ���ˮ��Ӧ������ԭ | |
| D�� | �ơ������ơ��������Ƶ���ɫ��Ӧ���Ի�ɫ |
| A�� | ԭ��������d��c��b��a | B�� | ԭ�Ӱ뾶��r��A����r��B����r��D����r��C�� | ||
| C�� | ���ʵĻ�ԭ�ԣ�A��B��D��C | D�� | ���Ӱ뾶��r��C3-����r��D-����r��B+����r��A2+�� |
| A�� | N2 | B�� | PCl3 | C�� | PCl5 | D�� | CO2 |
| A�� | ���ʵ� | B�� | �廯�� | C�� | ˮ | D�� | �Ȼ�þ |
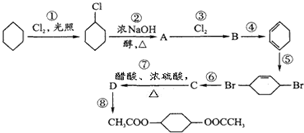 �ӻ�������Ʊ�1��4-���������������������й������йص�8����Ӧ���������������ﶼ����ȥ����
�ӻ�������Ʊ�1��4-���������������������й������йص�8����Ӧ���������������ﶼ����ȥ���� ��C
��C ��D
��D ��
�� ��
�� ��
�� ��
��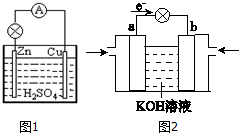 ԭ�����ֱ�Ӱѻ�ѧ��ת��Ϊ���ܵ�װ�ã�
ԭ�����ֱ�Ӱѻ�ѧ��ת��Ϊ���ܵ�װ�ã� ������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ������T��������������������������ȣ���ش���������
������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ������T��������������������������ȣ���ش���������