题目内容
20.四种短周期元素在表中位置如图,有关说法正确的是( )| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
分析 A.元素的非金属性越强,其氢化物越稳定;
B.应描述为Z元素最高价氧化物对应水化物的酸性一定强于Y的,不是最高价含氧酸,则不一定;
C.非金属越强,阴离子还原性越弱;
D.Z可以为Cl元素等,氯气与反应生成HCl与HClO,氯气表现氧化性、还原性.
解答 解:A.X、Y、Z中Y的非金属性最弱,最简单氢化物稳定性最弱的是Y,故A正确;
B.应描述为Z元素最高价氧化物对应水化物的酸性一定强于Y的,不是最高价含氧酸,则不一定,如硫酸为强弱,HClO为弱酸,故B错误;
C.非金属性X>Y,非金属越强,阴离子还原性越弱,故X元素形成的单核阴离子还原性弱于Y,故C错误;
D.Z可以为Cl元素等,氯气与反应生成HCl与HClO,氯气表现氧化性、还原性,故D错误,
故选:A.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意元素的不确定性,具有一定的开放性,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.以下化学用语正确的是( )
| A. | 苯的实验式 C6H6 | B. | 乙醇的分子式CH3CH2OH | ||
| C. | 乙烯的结构简式CH2CH2 | D. | 甲醛的结构式: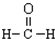 |
8.在密闭容器中发生反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为0.2mol•L-1、0.3mol•L-1和0.2mol•L-1,则平衡时各物质的浓度不可能是( )
| A. | X为0.25 mol•L-1 | |
| B. | Y为0.1 mol•L-1 | |
| C. | Z为0.2 mol•L-1 | |
| D. | Z为0.25 mol•L-1时,Y为0.45 mol•L-1 |
15.元素的性质随着原子序数的递增呈周期性变化的原因是( )
| A. | 元素的化合价的周期性变化 | |
| B. | 元素原子的原子半径的周期性变化 | |
| C. | 元素原子的核外电子排布的周期性变化 | |
| D. | 元素原子的电子层数的周期性变化 |
5.苯与乙烯、乙炔相比较,下列叙述不正确的是( )
| A. | 同质量的乙炔和苯完全燃烧生成二氧化碳的质量完全相等 | |
| B. | 都容易发生取代反应 | |
| C. | 苯只能在特殊条件下发生加成反应 | |
| D. | 苯不能被KmnO4所氧化 |
9.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠极易和水反应而被还原 | |
| D. | 钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
10.已知:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,下列说法正确的是(设NA为阿伏加德罗常数的值)( )
| A. | 氯气是氧化剂,FeCl3是还原剂 | |
| B. | 常温下,与56g Fe反应断裂1.5NA个Cl-Cl键 | |
| C. | 1 L 0.1 mol•L-1 FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 常温常压下,22.4 L Cl2和足量Fe反应转移3NA个电子 |

 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.