题目内容
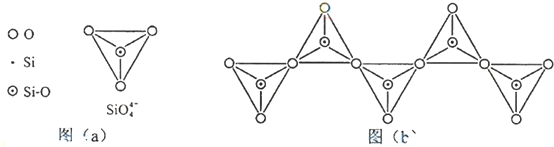
14.(1)H3PO2是一元中强酸,写出它与足量氢氧化钠反应的离子方程式H3PO2+OH-=H2PO2-+H2O,NaH2PO2为正盐(填“正盐”或“酸式盐”)(2)①在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3.
②写出CO2的路易斯结构式
 ;
;③第IIIA的元素由于最外能层的p能级中有空轨道,故称为缺电子元素.硼酸的结构式可表示为
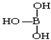 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.
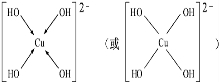
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.(3)向硫酸铜溶液中加入过量的NaOH溶液可生成 Cu(OH)42-,不考虑空间构型,Cu(OH)42-的结构可用示意图表示为
 .
.
分析 (1)H3PO2是一元中强酸,能和NaOH发生中和反应生成盐和水;NaH2PO2由酸根离子和钠离子构成,属于正盐;
(2)①根据价层电子对互斥理论判断原子杂化方式;
②路易斯结构式要标出孤电子对和共用电子对;
③硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键.
解答 解:(1)H3PO2是一元中强酸,能和NaOH发生中和反应生成盐和水且二者以1:1反应,反应方程式为H3PO2+OH-=H2PO2-+H2O;NaH2PO2由酸根离子和钠离子构成,属于正盐;
故答案为:H3PO2+OH-=H2PO2-+H2O;正盐;
(2)①该离子中每个Si原子价层电子对个数都是4,所以Si原子采用sp3杂化,故答案为:sp3;
②路易斯结构式要标出孤电子对和共用电子对,则二氧化碳路易斯结构式为 ,故答案为:
,故答案为: ;
;
③硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+,离子方程式为H3BO3+H2O?H4BO4-+H+,故答案为:H3BO3+H2O?H4BO4-+H+;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,故答案为:
,故答案为: .
.
点评 本题考查离子方程式的书写、配合物的成键情况、原子杂化方式判断等知识点,这些都是高频考点,知道价层电子对个数的计算方法,注意配位键的构成条件及表示方法,为易错点.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
4.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | 10mL0.1mol/L NH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10mL0.5mol/LCH3COONa溶液与6mL 1mol/L盐酸混合,c(Na+)=c(Cl-)>c(H+)>c(OH-) |
2.某课外兴趣小组对H2O2的分解速率做了如下实验探究:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
①验证影响反应速率的因素时要考试控制变量.取相同浓度的H2O2进行实验,上表反应条件中考虑控制单因子变量的是温度、浓度、催化剂.
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
①写出加入MnO2后H2O2发生反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
| 浓度 时间(s) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热(t1℃) | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热(t2℃) | 360(a) | 480 | 540 | 720 |
| MnO2催化剂、加热(t2℃) | 10(b) | 25 | 60 | 120 |
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.
9.氢能是未来能源结构中最具发展潜力的清洁能源之一.目前已有专家已研究出用淀粉或纤维素与水在酶作用下转变为二氧化碳和氢气的方法制氢气.下列说法错误的是( )
| A. | 从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| B. | 上述制氢气的化学方程式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$ 6nCO2↑+12nH2↑ | |
| C. | 氢元素的三种同素异形体${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$,能形成六种单质 | |
| D. | 从化学的本质看该反应属于氧化还原反应 |
6.某油脂样品跟氢氧化钠溶液共热后经酸化得到3种有机物,原样品最多可能含有的三羧酸甘油酯有( )
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 8种 |

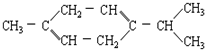 还可以简写为
还可以简写为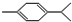 ,下列有机物中,与上述有机物互为同分异构体的是( )
,下列有机物中,与上述有机物互为同分异构体的是( )