题目内容
3.向1.0mol Fe2(SO4)3和1.0mol FeSO4的1L酸性混合溶液中通入NH3,至该溶液的pH为3时,所得溶液中c(Fe2+):c(Fe3+)=1:4×10-5(溶液体积变化忽略不计,Ksp(Fe(OH)2)=8.0×10-16,Ksp(Fe(OH)3)=4.0×10-38)分析 pH为3时,c(OH-)=10-11mol/L,结合Ksp(Fe(OH)2)=c(Fe2+)×c2(OH-)=8.0×10-16,Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=4.0×10-38)计算c(Fe2+):c(Fe3+).
解答 解:pH为3时,c(OH-)=10-11mol/L,则1.0mol FeSO4溶液中c(Fe2+)×c2(OH-)=10-22<8.0×10-16,没有沉淀生成,则c(Fe2+)=1.0mol/L,
由Ksp(Fe(OH)3)=4.0×10-38可知,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-11})^{3}}$mol/L=4×10-5mol/L,则c(Fe2+):c(Fe3+)=1:4×10-5,
故答案为:1:4×10-5.
点评 本题考查难溶电解质的溶解平衡,侧重于学生的分析、计算能力的考查,答题时注意把握溶度积的理解和运用,结合溶度积计算该题,难度不大.

练习册系列答案
相关题目
13.下列各组离子,能在溶液中大量共存的是( )
| A. | Ca2+、Al3+、NO3-、Cl- | B. | H+、Fe2+、SO42-、NO3- | ||
| C. | K+、NH4+、CO32-、OH-、 | D. | Na+、Mg2+、CO32-、Br- |
11.下列有关丙烷的叙述不正确的是( )
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易汽化,耗氧量少 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
18.下列说法正确的是( )
| A. | 淀粉、纤维素、油脂、蛋白质都属于高分子化合物 | |
| B. | 笔和墨的原料中都存在蛋白质 | |
| C. | 纸的主要成分属于糖类 | |
| D. | 将新鲜的土豆切开,一段时间后可观察到切面变蓝,说明土豆中含有Cu2+ |
12.近来查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,且其分子中所有原子最外层均达到8电子稳定结构.下列关于二氧化三碳的说法错误的是( )
| A. | 二氧化三碳的电子式为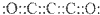 | B. | C3O2、CO、CO2都是碳的氧化物 | ||
| C. | C3O2和CO一样可以燃烧生成CO2 | D. | C3O2和CO2都是碳酸的酸酐 |
8.已知298K,1.01×105Pa条件下:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.9kJ•mol-1下列热化学方程式正确的是( )
| A. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.1kJ•mol-1 | |
| B. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=+200.7kJ•mol-1 | |
| C. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=-766.5kJ•mol-1 | |
| D. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=+41.1kJ•mol-1 |
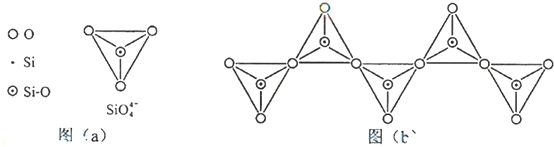
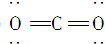 ;
;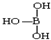 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.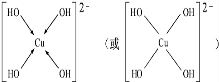 .
.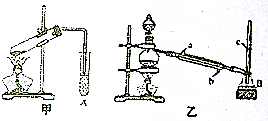 某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题:
某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题: