��Ŀ����
9��������δ����Դ�ṹ����߷�չDZ���������Դ֮һ��Ŀǰ����ר�����о����õ��ۻ���ά����ˮ��ø������ת��Ϊ������̼�������ķ���������������˵��������ǣ�������| A�� | ������ѭ�����������ø÷����õ���������Դ��̫���� | |
| B�� | �����������Ļ�ѧ����ʽ�ɱ�ʾΪ����C6H10O5��n+7nH2O$\stackrel{ø}{��}$ 6nCO2��+12nH2�� | |
| C�� | ��Ԫ�ص�����ͬ��������${\;}_{1}^{1}H$��${\;}_{1}^{2}H$��${\;}_{1}^{3}H$�����γ����ֵ��� | |
| D�� | �ӻ�ѧ�ı��ʿ��÷�Ӧ����������ԭ��Ӧ |
���� A�����õ�������ά����ȡ��������������ά����Դ����ɫֲ���̫����ת��ΪΪ��ѧ�ܣ���ѧ��ת��ΪΪ���ܣ�
B������������Ϣ�����ۻ���ά����ˮ��ø������ת��Ϊ������̼�������ķ�������������Ӧ��Ϊ���ۻ���ά�غ�ˮ��������Ϊ������̼��������
C����Ԫ�ص�����ͬ��������${\;}_{1}^{1}H$��${\;}_{1}^{2}H$��${\;}_{1}^{3}H$��ֻ���γ�����һ�ֵ��ʣ�
D���л��ϼ۵ı仯������������ԭ��Ӧ���ݴ˽�ɣ�
��� �⣺A����ɫֲ��Ļ�ѧ����Դ�ڹ��ܣ���̫���ܣ���ѧ����һ��������ת��Ϊ���ܣ���ô������ѭ�����������ø÷����õ���������Դ��̫���ܣ���A��ȷ��
B���������֪����ѧ��Ӧ����ʽΪ����C6H10O5��n+7nH2O$\stackrel{ø}{��}$ 6nCO2��+12nH2������B��ȷ��
C������ԭ�ӵ�������Ͽ��Եõ�������Է���������ͬ���������ӣ���������ֻ��һ�֣���C����
D���˷�Ӧ��HԪ����CԪ�صĻ��ϼ۾������仯���л��ϼ۱仯�ķ�Ӧ����������ԭ��Ӧ����D��ȷ����ѡC��
���� ������Ҫ�����������֮����ת������ѧ��Ӧ����ʽ��д��������ԭ��Ӧ�жϡ�ͬλ���Լ����ʵĸ���ȣ��ۺ��Խ�ǿ���ѶȲ���

 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�| A�� | c��Cl-����c��NH4+����c��H+����c��OH-�� | B�� | c��Cl-����c�� NH4+����c��OH-����c��H+�� | ||
| C�� | c�� NH4+����c��Cl-����c��OH-����c��H+�� | D�� | c�� NH4+��+c��NH3��H2O��=c��Cl-�� |
| A�� | ��þ�Ͻ��Ӳ�Ƚϴ��ƼغϽ��Ӳ�Ƚ�С | |
| B�� | ��Ϊ�ƵĽ����Ա�þҪǿ�������Ƶ��۵��þҪ�� | |
| C�� | þ���û�����ͭ�е�ͭ����Ҳ���û�����ͭ�е�ͭ | |
| D�� | �ڿ����ж��ܱ���ȼ�����ɵIJ��ﶼ��������������� |
| A�� |  ���Ȼ�狀�����������NH3 | B�� |  �������̺�Ũ���������� | ||
| C�� |  ��п����ϡ������H2 | D�� |  ��˫��ˮ�Ͷ���������O2 |
| A�� | ���ۡ���ά�ء���֬�������ʶ����ڸ߷��ӻ����� | |
| B�� | �ʺ�ī��ԭ���ж����ڵ����� | |
| C�� | ֽ����Ҫ�ɷ��������� | |
| D�� | �����ʵ������п���һ��ʱ���ɹ۲쵽���������˵�������к���Cu2+ |
�ܽ��/��g/100gˮ��
�¶�/�� ������ | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| ������ | Zn��OH��2 | Fe��OH��2 | Fe��OH��3 |
| Ksp����ֵ | 10-17 | 10-17 | 10-39 |
��1���õ�ص�������ӦʽΪMnO2+H++e-=MnOOH����ط�Ӧ�����ӷ���ʽΪ��2MnO2+Zn+2H+=2MnOOH+Zn2+��
��2��ά�ֵ���ǿ��Ϊ0.5A����ع�������ӣ���������п0.05g�����Ѿ�F=96500C/mol��
��3���ϵ�غ�״������ˮ�������ˣ���Һ����Ҫ��ZnCl2��NH4Cl�����߿���ͨ������Ũ����ȴ�ᾧ������գ���������Ҫ�ɷ���MnO2��̼�ۺ�MnOOH�������еõ��ϴ���MnO2������ķ����ǿ����м��ȣ���ԭ����̼��ת��Ϊ������̼��MnOOH����Ϊ�������̣�
��4���÷ϵ�ص�пƤ����ZnSO4•7H2O�Ĺ����У����ȥ��Ƥ�е��������������䷽���ǣ�����ϡH2SO4��H2O2���ܽ⣬����ΪFe3+�Ӽ����pHΪ2.7ʱ�����պó�����ȫ������Ũ��С��1��10-5mol•L-1ʱ��������Ϊ�����ӳ�����ȫ���������Ӽ����pHΪ6ʱ��п��ʼ�������ٶ�Zn2+Ũ��Ϊ0.1mol•L-1�������������̲���H2O2�ĺ����Zn2+��Fe2+���벻����ԭ����Zn��OH��2��Fe��OH��2��Ksp�����
 ������Ԫ�����ڱ��е�λ���ǵ�4���ڢ�A�壬��������������Ӧˮ����Ļ�ѧʽ��Ca��OH��2��
������Ԫ�����ڱ��е�λ���ǵ�4���ڢ�A�壬��������������Ӧˮ����Ļ�ѧʽ��Ca��OH��2��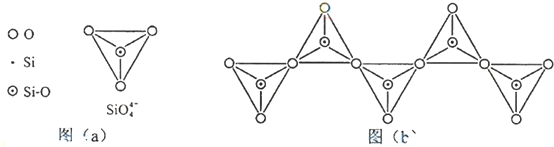
 ��
��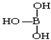 ������������ˮ��1�����������ˮ���ã�ֻ�ܲ���1��H+����д����������ˮ����Һ�����Ե����ӷ���ʽ��H3BO3+H2O?H4BO4-+H+��
������������ˮ��1�����������ˮ���ã�ֻ�ܲ���1��H+����д����������ˮ����Һ�����Ե����ӷ���ʽ��H3BO3+H2O?H4BO4-+H+��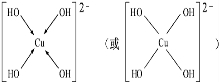 ��
��