题目内容
4.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业.CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化.以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是CuSO4或Cu2+,溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解.
(2)写出步骤③中主要反应的离子方程式2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+.
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是硫酸(写名称).
(4)上述工艺中,步骤⑥不能省略,理由是醇洗有利于加快去除CuCl表面水分防止其水解氧化.
(5)步骤②、④、⑤、⑧都要进行固液分离.工业上常用的固液分离设备有BD(填字母)
A、分馏塔 B、离心机 C、反应釜 D、框式压滤机
(6)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为0.597abm×100.
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,结合关系式解答该题.
解答 解:酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜.
(1)由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4或Cu2+,溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解,
故答案为:CuSO4或Cu2+;温度低溶解速度慢,温度过高铵盐分解;
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,
故答案为:硫酸;
(4)步骤⑥为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,
故答案为:醇洗有利于加快去除CuCl表面水分防止其水解氧化;
(5)步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,
故答案为:BD;
(6)氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
反应的关系式为6CuCl~6Fe2+~Cr2O72-,
6 1
n ab×10-3mol
n=6ab×10-3mol,
m(CuCl)=99.5g/mol×6ab×10-3mol=0.597abg,
则样品中CuCl的质量分数为0.597abm×100,
故答案为:0.597abm×100.
点评 本题为2015年高考题,题目考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用等,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及反应流程,难度中等,注意(6)中利用关系式的计算.

 名校课堂系列答案
名校课堂系列答案| A. | 二氧化三碳的电子式为 | B. | C3O2、CO、CO2都是碳的氧化物 | ||
| C. | C3O2和CO一样可以燃烧生成CO2 | D. | C3O2和CO2都是碳酸的酸酐 |
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为:2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗锌0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,两者可以通过加热浓缩冷却结晶分离回收,滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制作ZnSO4•7H2O的过程中,需除去铁皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,溶解,铁变为Fe3+加碱调节pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续加碱调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2的后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
| A. | 可以采用多次盐析和溶解的方法分离提纯蛋白质 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 肽键是蛋白质二级结构中的主键 | |
| D. | 用甘氨酸和丙氨酸缩合最多可以形成3种二肽 |
| A. | 糖类、油脂、蛋白质和DNA都是提供人体能量的重要物质基础 | |
| B. | 塑料管材、奶瓶、食物保鲜膜、大棚塑料薄膜等主要材料是聚氯乙烯 | |
| C. | SO2、NO2、NO、氟氯烃、CO2等均是造成大气污染的重要物质 | |
| D. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 |
| A. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.1kJ•mol-1 | |
| B. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=+200.7kJ•mol-1 | |
| C. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=-766.5kJ•mol-1 | |
| D. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=+41.1kJ•mol-1 |
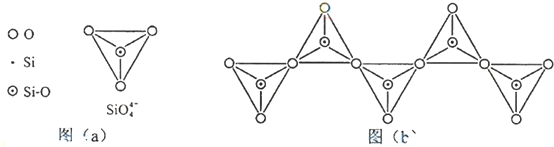
 ;
;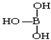 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.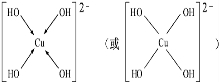 .
. (用电子式表示).
(用电子式表示).