题目内容
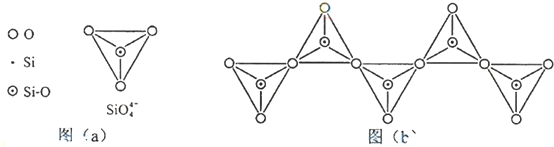
5.现有甲、乙、丙(如下图三种晶体的晶胞:甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶体中x与y的个数比是4:3,乙中a与b的个数比是1:1,丙晶胞中与c离子距离最近且相等的d离子有6个.
分析 根据均摊法可知,处于顶点的离子,同时为8个晶胞共有,每个离子有$\frac{1}{8}$属于晶胞;处于棱上的离子,同时为4个晶胞共有,每个离子有$\frac{1}{4}$属于晶胞;处于面上的离子,同时为两个晶胞共有,每个离子有$\frac{1}{2}$属于晶胞;处于内部的离子则完全属于该晶胞,据此答题.
解答 解:根据题中各晶胞结构图结合均摊法可知,甲图中每个晶胞中含有的x原子数为1,y原子数为6×$\frac{1}{8}$=$\frac{3}{4}$,所以x:y=1:$\frac{3}{4}$=4:3,
乙图中每个晶胞中含有的a原子数为1,b原子数为8×$\frac{1}{8}$=1,所以a:b=1:1,
丙晶胞中与c离子距离最近且相等的d离子在三维坐标中有6个离子,则与c离子距离最近且相等的d离子有6个,
故答案为:4:3;1:1;6.
点评 本题主要考查了均摊法和晶胞的结构,难度不大,注重基础知识的考查,答题时注意仔细观察晶胞的结构图.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
15.下列各组物质中,互为同位素的是( )
| A. | 重氢、超重氢 | B. | 氧、臭氧 | C. | 红磷、白磷 | D. | 乙酸、丙酸 |
16.下列说法正确的是( )
| A. | 青铜是我国使用最早的合金,也是目前使用最广泛的合金 | |
| B. | 不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样 | |
| C. | 我们日常生活中用到的铜合金制品主要是黄铜制的 | |
| D. | 各种铜合金都有良好的导电、导热性 |
13.下列各组离子,能在溶液中大量共存的是( )
| A. | Ca2+、Al3+、NO3-、Cl- | B. | H+、Fe2+、SO42-、NO3- | ||
| C. | K+、NH4+、CO32-、OH-、 | D. | Na+、Mg2+、CO32-、Br- |
20.下列关于镁和钠及其合金的比较结论正确的是( )
| A. | 铝镁合金的硬度较大,钠钾合金的硬度较小 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜中的铜,钠也能置换硫酸铜中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,无过氧化物 |
10.有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:(提示:请注意氢谱中峰的高度比)
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)有机物A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使 其产物依次通过足量无水硫酸铜粉末、足量石灰水,发现硫酸铜粉末增重5.4g,石灰水中有30.0g白色沉淀生成. | (2)9.0g有机物A完全燃烧时,经计算: 生成CO2共为0.3mol, 生成的H2O0.3mol. 有机物A的分子式C3H6O3. |
| (3)经红外光谱测定,证实其中含有O-H键,-COOH基团,C-H键;经核磁共振氢谱的测定,其核磁共振氢谱图 如:  | (3)A的结构简式 . . |
| (4)如果经红外光谱测定,A的一种同分异构体中,存在O-H键, 还含有醛基,C-O键,  核磁共振氢谱的测定, 其核磁共振氢谱图如右: | (4)A的这种同分异构体的结构简式为: CH2(OH)CH(OH)CHO. |
| (5)如果经红外光谱测定,A的一种同分异构体中,存在O-H键,还含有C=O,C-O键, 核磁共振氢谱的测定, 其核磁共振氢谱图如:  | (5)A的这种同分异构体的结构简式为: . . |
17.下列制备和收集气体的实验装置合理的是( )
| A. |  用氯化铵和氢氧化钙制NH3 | B. |  二氧化锰和浓盐酸制氯气 | ||
| C. |  用锌粒和稀硫酸制H2 | D. |  用双氧水和二氧化锰制O2 |
 ;
;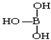 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.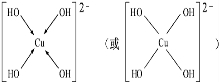 .
.