题目内容
4.下列混合溶液中,各离子浓度的大小顺序正确的是( )| A. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | 10mL0.1mol/L NH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10mL0.5mol/LCH3COONa溶液与6mL 1mol/L盐酸混合,c(Na+)=c(Cl-)>c(H+)>c(OH-) |
分析 A.物质的量相等的氨水和HCl混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,溶液呈酸性;
B.物质的量相等的氯化铵和NaOH混合,二者恰好反应生成NaCl和NH3.H2O,NaCl是强碱强酸盐,一水合氨电离出氢氧根离子导致溶液呈碱性,但电离程度较小,溶液中存在物料守恒;
C.等物质的量的醋酸和NaOH混合,二者恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性;
D.二者混合盐酸有剩余,溶液中溶质为NaCl、CH3COOH、HCl,且c(NaCl)=c(CH3COOH)=5c(HCl),醋酸和HCl电离出氢离子而导致溶液呈酸性.
解答 解:A.物质的量相等的氨水和HCl混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),铵根离子水解程度较小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.物质的量相等的氯化铵和NaOH混合,二者恰好反应生成NaCl和NH3.H2O,NaCl是强碱强酸盐,一水合氨电离出氢氧根离子导致溶液呈碱性,则c(OH-)>c(H+),但电离程度较小,溶液中存在物料守恒,根据物料守恒得c(Na+)=c(Cl-),所以离子浓度大小顺序是c(Na+)=c(Cl-)>c(OH-)>c(H+),故B正确;
C.等物质的量的醋酸和NaOH混合,二者恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO-),故C错误;
D.二者混合盐酸有剩余,溶液中溶质为NaCl、CH3COOH、HCl,且c(NaCl)=c(CH3COOH)=5c(HCl),醋酸和HCl电离出氢离子而导致溶液呈酸性,则c(H+)>c(OH-),根据物料守恒得c(Na+)>c(Cl-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,侧重考查弱电解质的电离及盐类水解,明确溶液中的溶质及其性质、溶液酸碱性结合电荷守恒即可解答,注意B中存在c(Na+)=c(Cl-),为易错点.

| A. | 氯化氢 | B. | 食盐水 | C. | 铜 | D. | 二氧化碳 |
| A. | 重氢、超重氢 | B. | 氧、臭氧 | C. | 红磷、白磷 | D. | 乙酸、丙酸 |
| A. | 体系颜色比原来深 | B. | 体系颜色比原来浅 | ||
| C. | 体系颜色不变 | D. | 注射器内压强不变 |
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(Cl-)>c( NH4+)>c(OH-)>c(H+) | ||
| C. | c( NH4+)>c(Cl-)>c(OH-)>c(H+) | D. | c( NH4+)+c(NH3.H2O)=c(Cl-) |
| A. | 溶液的pH将增大 | B. | 钠离子数和碳酸根离子数的比变小 | ||
| C. | 溶液浓度增大并有晶体析出 | D. | 溶液浓度不变,有晶体析出 |
| A. | 青铜是我国使用最早的合金,也是目前使用最广泛的合金 | |
| B. | 不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样 | |
| C. | 我们日常生活中用到的铜合金制品主要是黄铜制的 | |
| D. | 各种铜合金都有良好的导电、导热性 |
| A. | Ca2+、Al3+、NO3-、Cl- | B. | H+、Fe2+、SO42-、NO3- | ||
| C. | K+、NH4+、CO32-、OH-、 | D. | Na+、Mg2+、CO32-、Br- |
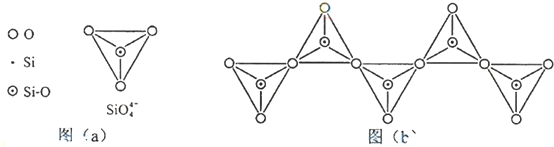
 ;
;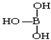 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:H3BO3+H2O?H4BO4-+H+.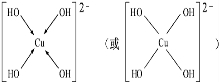 .
.