题目内容
20.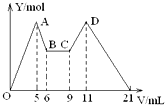 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )| A. | 从6到9,相应离子反应方程式为H++OH-=H2O | |
| B. | A 是NaOH,B是盐酸,且c(NaOH):c( HCl)=2:1 | |
| C. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| D. | A是盐酸,B是NaOH,且c(NaOH)=2c (HCl) |
分析 根据图象可知先加入的试剂A一开始就产生沉淀,而随试剂的加入沉淀部分溶解,所以试剂A为NaOH,后来加入的试剂B沉淀的量不变是盐酸与过量的碱反应,继续加试剂B,沉淀的是增加是偏铝酸盐与酸反应生成沉淀氢氧化铝,当偏铝酸盐全部转化为氢氧化铝,再滴入酸,又溶解了氢氧化铝和氢氧化镁,所以试剂B为盐酸,
A、6-9mL之间沉淀量没有发生改变说明盐酸在中和过量的NaOH;
B、根据AB段用了1mL,CD段用了2mL,可知NaOH的浓度是盐酸浓度的2倍;
C、根据AB段用了1mL,OA段用了5mL可知原混合溶液中c(Al3+):c(Mg2+)=1:1,结合电荷守恒分析c(Al3+):c(Mg2+):c(Cl-)的值;
D、试剂A为NaOH,后加入的试剂B为盐酸.
解答 解:A、在6mL处由原来的滴加NaOH,改为滴加盐酸,由图象知6mL~9mL时对应液体中沉淀量不变,可以推知此时仅仅发生酸碱中和反应,即H++OH-=H2O,故A正确;
B、根据加入前6mL试剂时,先有沉淀生成而后溶解,所以,试剂A是NaOH,则B是盐酸;又由图可知,5→6(1mL)为Al(OH)3的溶解,发生反应:Al(OH)3↓+NaOH=NaAlO2+2H2O,9→11(2 mL)为AlO2-恰好完全生成Al(OH)3沉淀:发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,根据铝元素守恒知:
NaOH~Al(OH)3~AlO2-~H+
1 1 1 1
由此可以推出:n(NaOH)=n(HCl)又因为v(NaOH):v(HCl)=1:2,所以:c(NaOH):c(HCl)=2:1,故B正确;
C、设氢氧化钠的浓度为6mol/l,从加入5mLA生成沉淀最多,再继续加1mLA沉淀量减少到最小值,滴加氢氧化钠在5→6(1 mL)时相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n[Al(OH)3]=(1×6×10-3)mol;由前5mLNaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3)mol,溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故C正确;
D、试剂A为NaOH,后加入的试剂B为盐酸,由B可知,c(NaOH)=2c (HCl),故D错误;
故选D.
点评 本题考查了镁、铝重要化合物的性质,题目难度较大,能正确分析图象中转折线发生的化学反应是解本题的关键.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
| A. | 加入一种反应物 | B. | 增大体系的压强 | C. | 升高温度 | D. | 扩大容器体积 |
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
| A. | 自然界存在大量硅单质 | |
| B. | 自然界的硅易开采,且可再生 | |
| C. | 硅燃料便于运输、贮存,从安全角度考虑,硅是优质燃料 | |
| D. | 硅燃料燃烧放出的热量多,其燃烧产物对环境的污染容易有效地控制 |
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
| A. |  | B. |  | ||
| C. |  | D. |  |
 某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑. (C)
(C) (D)
(D)
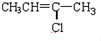 (G)
(G)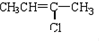 (H)
(H)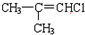
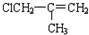 (J)
(J)