题目内容
15.下列关于电解池中形成的闭合回路的叙述中,正确的是( )| A. | 电解池中的闭合回路仅是由电子的定向运动形成的 | |
| B. | 金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 | |
| C. | 在电解质溶液中,阴离子向阴极运动,阳离子向阳极运动 | |
| D. | 相同时间内,阳离子在阴极上得到的电子与阴离子在阳极上失去的电子数相同 |
分析 电解池的阳极发生氧化反应,阳极失去电子被氧化,
A、外电路电子定向移动,内电路是离子的定向移动;
B、金属导线中,电子从电源的负极流向电解池的阴极,从电解池的阳极流向电源的正极;
C、电解池中阴离子向阳极移动;阳离子向阴极移动;
D、整个电路转移电子数相等.
解答 解:A、外电路电子定向移动,内电路是离子的定向移动,故A错误;
B、金属导线中,电子从电源的负极流向电解池的阴极,从电解池的阳极流向电源的正极,故B错误;
C、电解池中阴离子向阳极移动;阳离子向阴极移动,故C错误;
D、整个电路转移电子数相等,所以同时间内,阳离子在阴极上得到的电子数与阴离子在阳极上失去的电子数相等,故D正确;
故选D.
点评 本题考查电解池知识,为高考常见题型,侧重于考查学生的化学知识的综合运用,难度不大,注意把握电解池的工作原理.

练习册系列答案
相关题目
5.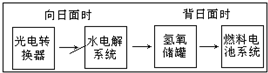 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 燃料电池系统产生的能量实际上来自于水 | |
| B. | 该能量转化系统中的水也是可能循环的 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
3.在某温度时,测得纯水中的[H+]=2.0×10-7 mol•L-1,则[OH-]为( )
| A. | 2.0×10-7 mol•L-1 | B. | 0.1×10-7 mol•L-1 | ||
| C. | 1.0×10-14/2.0×10-7 mol•L-1 | D. | 无法确定 |
10.把0.05mol NaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
20.工业合成氨反应是700K左右进行的,这主要原因是( )
| A. | 700K时此反应速率最快 | |
| B. | 700K时氨的平衡浓度最大 | |
| C. | 700K时氨的转化率最高 | |
| D. | 700K该反应的催化剂能发挥最大的作用 |
7.某电中性溶液中含有K+、Mg2+、Cl-、SO42-四种离子,其中K+、Mg2+、Cl-的个数比为5:2:3,则溶液中Mg2+与SO42-的个数比为( )
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:5 |
4.只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是( )
| A. | Fe(NO3)3溶液 | B. | FeCl2溶液 | C. | BaCl2溶液 | D. | FeCl3溶液 |
5.有科学家认为:硅是“21世纪的能源”、“未来的石油”,下列有关硅可能成为新型能源的依据的叙述中不正确的是( )
| A. | 自然界存在大量硅单质 | |
| B. | 自然界的硅易开采,且可再生 | |
| C. | 硅燃料便于运输、贮存,从安全角度考虑,硅是优质燃料 | |
| D. | 硅燃料燃烧放出的热量多,其燃烧产物对环境的污染容易有效地控制 |