题目内容
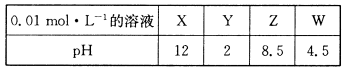
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+) c(CH3COO-)。
(1)B ;
(2)D;
(3)CH3COOH和CH3COONa ;
(4)> ; =。
解析试题分析:(1) B中不符合电荷守恒
(2)当溶液中只有一种溶质是必须为醋酸钠,则醋酸钠溶液中各离子浓度大小顺序为c (Na+)>c(CH3COO-)>c (OH-)>c (H+),因为醋酸根离子是弱酸根,会水解。
(3)因为溶液为酸性,所以存在醋酸,酸性溶液中不可能是氢氧化钠,所以只能是醋酸钠;
(4) 因为醋酸是弱酸,弱电解质,不能完全电离,而溶液体积相等,当恰好中和时,c(CH3COOH)>c(NaOH);因为恰好呈中性,氢离子与氢氧根离子的物质的量浓度恰好相等,因为电荷守恒,所以c(Na+)=c(CH3COO-)
考点:考查离子。

有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 | Na+、Ba2+、NH4+ | 阴离子 | CO32-、Cl-、OH-、SO42- |
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中
 = ;
= ;(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀,从而将其除去的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp(mol2·L-2) | 3×10-9 | 9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④向沉淀中加入足量的盐酸。
(1)步骤①所得悬浊液中[Ca2+]=________ mol·L-1
(2)写出第②步发生反应的离子方程式:________________________________.
(3)设计第③步的目的是________________________________________________.
(4)第④步操作发生的现象为: 。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: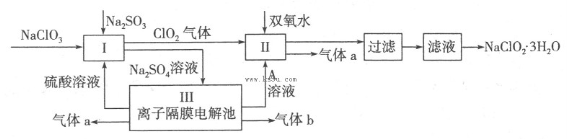
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。