题目内容
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.0 1 mol·L-1的X、Y、Z、W溶液的pH。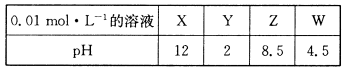
(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。
(1)NaOH;NH4NO3(2)NH4NO3=NH4++NO3-(3)NO2-+H2O HNO2+OH-
HNO2+OH-
(4)c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)
(5)NaNO2+NH4NO3 NaNO3+N2↑+2H2O
NaNO3+N2↑+2H2O
解析试题分析:(1)HNO3是强酸,0.01mol·L-1 HNO3溶液的pH为2,NH4NO3是强酸弱碱盐,NH4+不完全水解生成H+溶液显酸性pH小于7,NaOH为强碱,0.01mol·L-1NaOH溶液的pH为12,NaNO2是强碱弱酸盐溶液,NO2—在溶液中水解显碱性pH大于7,故X为NaOH,Y为HNO3,Z为NaNO2,W为 NH4NO3(2)NH4NO3在溶液中完全电离生成NH4+与NO3-,电离方程式:NH4NO3=NH4++NO3-(3)NO2-在溶液中水解生成HNO2与OH-,使溶液显碱性,离子方程式NO2-+H2O HNO2+OH-(4)由题意知,混合溶液中各离子的浓度大小顺序即为物质的量大小顺序,设每种溶液各1L,则在Na+溶液中完全电离物质的量为2mol,NO3-在溶液中完全电离物质的量为1mol,NaOH中OH-与HNO3中H+等物质的量完全反应,NO2-在溶液中部分水解产生OH-,混合溶液中H+由水电离,故浓度大小顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)(5)NaNO2溶液与NH4NO3溶液混合加热,产生一种无色无味的单质气体只可能为N2反应方程式:NaNO2+NH4NO3
HNO2+OH-(4)由题意知,混合溶液中各离子的浓度大小顺序即为物质的量大小顺序,设每种溶液各1L,则在Na+溶液中完全电离物质的量为2mol,NO3-在溶液中完全电离物质的量为1mol,NaOH中OH-与HNO3中H+等物质的量完全反应,NO2-在溶液中部分水解产生OH-,混合溶液中H+由水电离,故浓度大小顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)(5)NaNO2溶液与NH4NO3溶液混合加热,产生一种无色无味的单质气体只可能为N2反应方程式:NaNO2+NH4NO3 NaNO3+N2↑+2H2O
NaNO3+N2↑+2H2O
考点:化学方程式的书写;离子浓度的判定;盐类的水解与电离

A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种。欲将它们一一鉴别,甲、乙、丙分别提出如下方案,请回答有关问题:
(1)甲同学用物质X一次性鉴别上述四种物质,他将适量的X溶液分别加入到四种溶液中,结果发现:C溶液变为棕黄色;B溶液中有白色沉淀产生;D溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,同时产生白色沉淀,最终变为红褐色。
B的化学式是________;D的电子式是________;X的化学式是________;A溶液中水的电离程度________(填“大于”、“小于”或“等于”)C溶液中水的电离程度。
(2)乙同学提出用明矾来鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同学用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液时,发现沉淀均溶解。有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故。
| 0.01 mol·L-1 电解质溶液 | HF | CH3COOH | HCN | NH3·H2O |
| 酸中H+或碱 中OH-的浓度/mol·L-1 | 8.00×10-4 | 1.32×10-4 | 1.00×10-4 | 1.33×10-4 |
若要证明A和B哪一种解释正确,可以在生成的Mg(OH)2沉淀中加入一种物质,这种物质的化学式为__________________。
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4
③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,实验后装置C中所得溶液离子浓度关系一定正确的是(选填字母)
| A.(Na+)= 2c(SO32-)+ c(HSO3-), |
| B.(Na+)> c(HSO3-)> c(SO32-)> c(H+)> c(OH-), |
| C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-), |
| D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-) |
乙同学的推测是:2Mg+3SO2
 2MgSO3+S;
2MgSO3+S;丙同学的推测是:3Mg+SO2
 2MgO+MgS,
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。请填写下表中的空格:

根据上述实验探究,能证明甲同学推测正确的操作和预期现象是_________________ _
(4)上述实验需要50mL,2mol/L的HCl,配制时应选用 (10 mL ,25 mL ,,50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积。
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程 。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是 。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是 。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是 。
③乙同学这样配制混合溶液的理由是 。
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+) c(CH3COO-)。
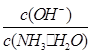 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。