题目内容
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
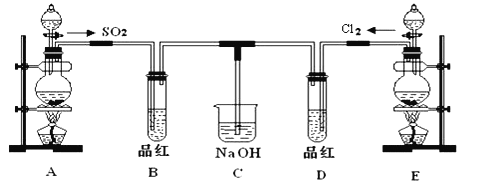
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是__________.
(2)实验室用装置E制备Cl2,其反应的化学方程式为__________;若有8mol的HCl参加反应,则转移的电子总数为__________.
(3)该装置中氢氧化钠溶液的作用是__________
(4)通气后B、D两个试管中的现象分别为B:________D:________.停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:______________D:___________.
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红的颜色_________.请你分析该现象的原因(用化学方程式表示)__________.
【答案】分液漏斗活塞未打开 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 4NA 尾气处理 褪色 褪色 变为红色 无变化 无变化 SO2+Cl2+2H2O = 2HCl+H2SO4
MnCl2+Cl2↑+2H2O 4NA 尾气处理 褪色 褪色 变为红色 无变化 无变化 SO2+Cl2+2H2O = 2HCl+H2SO4
【解析】
(1)依据分液漏斗使用方法和作用进行解答;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气和氯化锰、水;
(3)SO2和Cl2均有毒,可以与氢氧化钠反应;
(4)SO2和氯水均具有漂白性,可漂白品红溶液;二氧化硫能够与有色物质化合生成无色物质,因而具有漂白性,该无色化合物具有不稳定性,受热容易分解;氯水因为具有强氧化性而漂白品红溶液,加热后无变化;
(5)氯水具有强氧化性可与二氧化硫反应。
(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开A的分液漏斗活塞后,漏斗中液体未流下,原因是:分液漏斗的玻璃塞未打开;
故答案为:分液漏斗的玻璃塞为打开;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气和氯化锰、水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)SO2和Cl2均有毒,故C装置中氢氧化钠溶液的作用是:尾气处理,
故答案为:尾气处理;
(4)因二氧化硫可以漂白品红,氯气溶于水后也具有漂白性,则通气后B、D两个试管中的现象均是品红溶液褪色,又因为二氧化硫的漂白原理是其能够与有色物质化合生成无色物质,因而具有漂白性,但该无色化合物具有不稳定性,受热容易分解,加热后溶液恢复原来的红色;而氯水因强氧化性漂白的品红溶液,反应不可逆,故受热后现象无变化,
故答案为:褪色;褪色;变为红色;无变化;
(5)SO2和Cl2按1:1通入溶液中,发生氧化还原反应,其化学方程式为:SO2+Cl2+2H2O = 2HCl+H2SO4,即将两者按1:1同时通入品红溶液中,品红的颜色不会变化,
故答案为:无变化;SO2+Cl2+2H2O = 2HCl+H2SO4。