题目内容
12.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )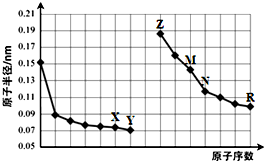
| A. | X、R两种元素的气态氢化物的稳定性:R>X | |
| B. | 简单离子的半径:Y>Z>M | |
| C. | N的单质能与Z的最高价氧化物对应的水化物反应 | |
| D. | Z与X两种元素形成的化合物都是碱性氧化物 |
分析 同一周期元素,原子半径随着原子序数增大而减小;电子层数越多原子半径越大,根据图中元素原子半径与原子序数关系知,Z、M、N、R分别是Na、Al、Si、Cl元素;X、Y分别是O、F元素,
A.元素的非金属性越强,其氢化物越稳定;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.N的单质是Si,Z的最高价氧化物的水化物是NaOH,Si能和NaOH反应;
D.Z和X两种元素形成的化合物是过氧化钠不是碱性氧化物.
解答 解:同一周期元素,原子半径随着原子序数增大而减小;电子层数越多原子半径越大,根据图中元素原子半径与原子序数关系知,Z、M、N、R分别是Na、Al、Si、Cl元素;X、Y分别是O、F元素,
A.元素的非金属性越强,其氢化物越稳定,非金属性O>Cl,所以氢化物的稳定性X>R,故A错误;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Y>Z>M,故B正确;
C.N的单质是Si,Z的最高价氧化物的水化物是NaOH,Si能和NaOH反应生成硅酸钠和氢气,故C正确;
D.Z和X两种元素形成的化合物是过氧化钠和水反应生成氢氧化钠和氧气,所以不是碱性氧化物,故D错误;
故选BC.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查元素周期律、物质性质及结构,易错选项是D,注意过氧化钠不是碱性氧化物.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
20.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
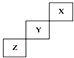

| A. | X单质的熔点比Z的低 | |
| B. | X、Y、Z三种元素中,X的非金属性最强 | |
| C. | Y氢化物的稳定性比Z的氢化物弱 | |
| D. | Y的最高正化合价为+7 |
7.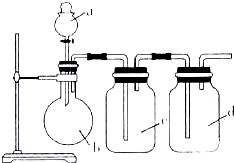 拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
 拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )| 选项 | 制取气体 | a | b | c | d |
| A | NO | 稀硝酸 | 铜片 | H2O | 浓硫酸 |
| B | O2 | 双氧水 | MnO2 | H2O | 浓硫酸 |
| C | NH3 | 浓氨水 | 碱石灰 | 浓硫酸 | H2O |
| D | SO2 | 浓盐酸 | Na2SO3粉末 | NaHSO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
17.某学生要提纯混有泥沙的食盐,他设计的主要操作有:溶解、过滤、蒸发.在这些操作中都需要使用的仪器是( )
| A. | 烧杯 | B. | 漏斗 | C. | 玻璃棒 | D. | 酒精灯 |
4.有X、Y两种元素,相对原子质量分别为56、16,化合价分别为+3和-2,则X和Y组成的化合物的相对分子质量为?( )
| A. | 72 | B. | 88 | C. | 160 | D. | 200 |