题目内容
17.某学生要提纯混有泥沙的食盐,他设计的主要操作有:溶解、过滤、蒸发.在这些操作中都需要使用的仪器是( )| A. | 烧杯 | B. | 漏斗 | C. | 玻璃棒 | D. | 酒精灯 |
分析 溶解需要烧杯、玻璃棒;过滤需要铁架台、漏斗、烧杯、玻璃棒;蒸发需要铁架台、酒精灯、玻璃棒,以此来解答.
解答 解:提纯混有泥沙的食盐,主要操作有溶解、过滤、蒸发,均使用的仪器为玻璃棒,作用分别为搅拌、引流、搅拌(防止局部温度过高),
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握粗盐提纯的实验方法及仪器为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
7.下列化合物中不含离子键的是( )
| A. | (NH4)2S | B. | Al2(SO4)3 | C. | CsOH | D. | HNO3 |
5.下表列出了A~R九种元素在周期表中的位置,请按要求回答下列问题:
(1)已知A是短周期中金属性最强的元素,则A、C、G、F四种元素按离子半径由大到小的顺序排列为r(Cl-)>r(F-)>r(Na+)>r(Mg2+);(用“微粒符号”填空)
(2)这九种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4、碱性最强的是KOH;(用“化学式”填空)
(3)F、G、H三种元素对应氢化物中沸点最高的是HF,原因是HF分子间既有范德华力也存在氢键而氯化氢、溴化氢的分子间只有范德华力没有氢键,氢键是一种比范德华力要稍强的作用;
(4)实验室检验B元素需要用到的特殊用品为蓝色钴玻璃;
(5)请用电子式表示化合物CF2的形成过程 .
.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| E | F | ||||||
| A | C | D | G | R | |||
| B | H |
(2)这九种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4、碱性最强的是KOH;(用“化学式”填空)
(3)F、G、H三种元素对应氢化物中沸点最高的是HF,原因是HF分子间既有范德华力也存在氢键而氯化氢、溴化氢的分子间只有范德华力没有氢键,氢键是一种比范德华力要稍强的作用;
(4)实验室检验B元素需要用到的特殊用品为蓝色钴玻璃;
(5)请用电子式表示化合物CF2的形成过程
 .
.
12.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )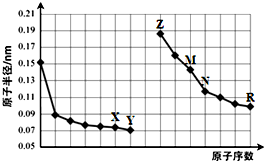

| A. | X、R两种元素的气态氢化物的稳定性:R>X | |
| B. | 简单离子的半径:Y>Z>M | |
| C. | N的单质能与Z的最高价氧化物对应的水化物反应 | |
| D. | Z与X两种元素形成的化合物都是碱性氧化物 |
2.下列物质中属于纯净物的是( )
| A. | 医用酒精 | B. | 生理盐水 | C. | 碘酒 | D. | 冰水混合物 |
9.碱金属和卤素形成的化合物大多具有的性质是( )
①较高沸点
②能溶于水
③水溶液能导电
④熔点很低
⑤熔融状态不导电.
①较高沸点
②能溶于水
③水溶液能导电
④熔点很低
⑤熔融状态不导电.
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
7.设NA为阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 16g的CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1 NaCl溶液中含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA |
