题目内容
3.实验室常用邻苯二甲酸氢钾(KHC8H4O4)来滴定氢氧化钠的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O.若氢氧化钠的溶液浓度为0.1mol•L-1,到达终点时,溶液的PH约为9.1.(1)为标定氢氧化钠溶液的浓度,应选酚酞用作指示剂,达到滴定终点时溶液由无色变为浅红色.
(2)在测定氢氧化钠溶液浓度时,有下列操作:①向溶液中加入1-2滴指示剂 ②向锥形瓶中加20-30ml蒸馏水溶解 ③用氢氧化钠溶液滴定到终点,半分钟不褪色④重复以上操作 ⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250ml锥形瓶中⑥根据两次实验数据计算氢氧化钠的物质的量浓度.以上各步中,正确的(填序号)操作顺序是⑤②①③④⑥
(3)上述操作中,将邻苯二甲酸氢钾直接放到锥形瓶中溶解,对实验是否有影响?无影响并说明理由:因为是否加入不影响邻苯二甲酸氢钾的物质的量
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果偏小(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(分子量204.2)晶体0.5105g,溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH 20mL,则NaOH溶液的浓度为0.1250mol•L-1(结果保留四位有效数字).
分析 (1)根据滴定终点的pH要在指示剂的变色范围之内确定指示剂;根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
(2)依据中和滴定有检漏、洗涤、润洗、装液、取待测液、滴定等操作分析判断;
(3)锥形瓶可用于溶解固体;
(4)根据c(待测)=$\frac{V(标准)c(标准)}{V(待测)}$来分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)根据KHC8H4O4+NaOH=KNaC8H4O4+H2O来解答.
解答 解:(1)邻苯二甲酸氢钾为弱酸,终点时溶液的pH约为9.1,滴定终点的pH要在指示剂的变色范围之内,所以选用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:酚酞;无;浅红;
(2)中和滴定按照检漏、洗涤、润洗、装液、取待测液、滴定等顺序操作,则操作顺序为⑤②①③④⑥;
故答案为:⑤②①③④⑥;
(3)将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验无影响;
故答案为:无影响,因为是否加入不影响邻苯二甲酸氢钾的物质的量;
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,NaOH溶液稀释,物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{V(标准)c(标准)}{V(待测)}$分析,c(待测)偏小;
故答案为:偏小;
(5)0.5105gKHC8H4O4的物质的量为$\frac{0.5105g}{204.2g/mol}$=0.0025mol,
KHC8H4O4 +NaOH=KNaC8H4O4+H2O
1 1
0.0025mol 0.02L×c(NaOH)
解得:c(NaOH)=0.1250 mol/L
故答案为:0.1250 mol/L.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,根据课本知识即可完成,掌握基础是关键.

 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A. | 2.7gAl与足量的该硫酸反应可得到标准状况下的H2 3.36L | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| A. | 3:3:5 | B. | 3:5:3 | C. | 5:3:3 | D. | 8:7:7 |
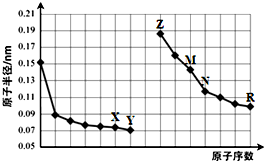
| A. | X、R两种元素的气态氢化物的稳定性:R>X | |
| B. | 简单离子的半径:Y>Z>M | |
| C. | N的单质能与Z的最高价氧化物对应的水化物反应 | |
| D. | Z与X两种元素形成的化合物都是碱性氧化物 |
| A. | 硅酸钠溶液中逐滴加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na2+ | |
| B. | 向氢氧化钠溶液中加入醋酸溶液:OH-+H+=H2O | |
| C. | 铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
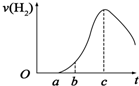 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题: 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.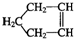 可简写为
可简写为 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: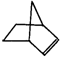
 .
.