题目内容
14.关于硬铝废料(含90%铝、2.5%镁、7.5%铜)的利用,某探究小组进行了如图实验.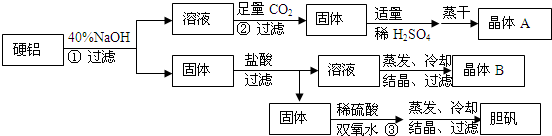
试回答下列问题:
(1)写出晶体A的一种用途净水剂,写出晶体B的化学式MgCl2•6H2O.
(2)写出反应①、②、③的离子方程式.①2Al+2H2O+2OH-=2AlO2-+3H2↑ ②AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-③Cu+H2O2+2H+=Cu2++2H2O.
分析 由流程图分析可知,硬铝中铝与氢氧化钠反应生成偏铝酸钠,故溶液含有偏铝酸钠,向溶液中通入足量的二氧化碳,偏铝酸根与二氧化碳、水反应,生成氢氧化铝沉淀,所以固体为氢氧化铝,向固体加入硫酸,氢氧化铝与硫酸反应生成硫酸铝和水,蒸干析出硫酸铝晶体;过滤得到的固体为镁和铜,与盐酸反应,得到溶液为氯化镁,不反应的固体为铜,铜与双氧水、稀硫酸反应生成硫酸铜和水;得到的氯化镁溶液蒸干、冷却、结晶、过滤得晶体B为MgCl2•6H2O,据此分析解答.
解答 解:由流程图分析可知,硬铝中铝与氢氧化钠反应生成偏铝酸钠,故溶液含有偏铝酸钠,向溶液中通入足量的二氧化碳,偏铝酸根与二氧化碳、水反应,生成氢氧化铝沉淀,所以固体为氢氧化铝,向固体加入硫酸,氢氧化铝与硫酸反应生成硫酸铝和水,蒸干析出硫酸铝晶体;过滤得到的固体为镁和铜,与盐酸反应,得到溶液为氯化镁,不反应的固体为铜,铜与双氧水、稀硫酸反应生成硫酸铜和水;得到的氯化镁溶液蒸干、冷却、结晶、过滤得晶体B为MgCl2•6H2O;
(1)根据以上分析,晶体A为硫酸铝,一种用途为作净水剂,晶体B为MgCl2•6H2O,故答案为:净水剂;MgCl2•6H2O;
(2)根据以上分析,①为铝与氢氧化钠反应,离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑;②为偏铝酸根与二氧化碳、水反应,生成氢氧化铝沉淀和碳酸氢跟,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;③为铜与双氧水、稀硫酸反应生成硫酸铜和水,离子方程式为:Cu+H2O2+2H+=Cu2++2H2O,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;Cu+H2O2+2H+=Cu2++2H2O.
点评 本题考查了物质制备实验过程分析和分离方法,知识涉及元素化合物、实验原理等,侧重考查学生对实验方案理解、元素化合物的知识应用、实验基本操作的步骤叙述,难度中等.

 阅读快车系列答案
阅读快车系列答案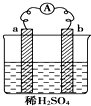
| A. | 反应后a极质量减小 | |
| B. | 碳棒上有气体逸出 | |
| C. | 导线上有电流,电子流动方向从a→b | |
| D. | a极上发生还原反应,b极上发生氧化反应 |
| A. | 向AlCl3溶液中加入过量氨水:Al3++3 NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 向硝酸亚铁溶液中加入稀硫酸:3Fe2++NO3-+4H+═3Fe3++2H2O+NO↑ | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
| A. | 乙烯使溴水或酸性高锰酸钾褪色均属于加成反应 | |
| B. | 用乙醇与浓硫酸加热至170℃制乙烯的反应属于取代反应 | |
| C. | 用“地沟油”生产生物柴油只发生酯化反应 | |
| D. | 用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 |
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$
 .
. ;该反应类型酯化反应
;该反应类型酯化反应
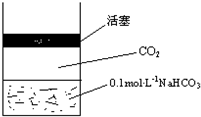 在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )
在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )