题目内容
6.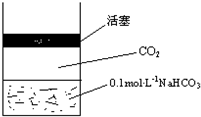 在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )
在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )| A. | 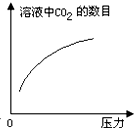 | B. | 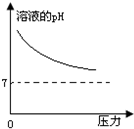 | C. |  | D. | 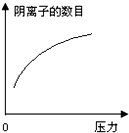 |
分析 上图的溶液中,存在HCO3-的电离平衡、水解平衡,溶液中还存在碳酸,碳酸是弱酸,碳酸溶液中存在二氧化碳的溶解平衡和电离平衡,CO2+H2O?H2CO3,H2CO3?H++HCO3-,HCO3-?H++CO32-,压力增大,导致活塞下移,二氧化碳在水中的溶解度增大,c(H2CO3)增大,碳酸的电离平衡正向移动,溶液酸性增强,pH降低,阴阳离子数目都增大,据此分析.
解答 解:A、碳酸溶液中存在二氧化碳的溶解平衡,压力增大,导致活塞下移,二氧化碳在水中的溶解度增大,所以随压力增大二氧化碳分子在水中溶解数目增多,故A正确;
B、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液酸性增强,pH降低,会小于7,故B错误;
C、水解平衡常数只受温度影响,温度不变水解平衡常数不变,故C正确;
D、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液中阴阳离子数目都增大,故D正确;
故选B.
点评 本题考查了气体的溶解平衡以及弱电解质的电离平衡,注意图象分析,题目难度中等.

练习册系列答案
相关题目
17.碱性强弱介于KOH和Mg(OH)2之间的氢氧化物( )
| A. | Be(OH )2 | B. | Al(OH)3 | C. | NaOH | D. | RbOH |
1.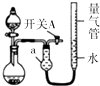 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)仪器a的名称是干燥管.
(2)检查该装置的气密性的方法是:关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高,说明气密性良好.
(3)该同学认为实验①可通过收集测量NO2气体的体积,来探究Cu样品的纯度.请问是否可行否(填“是”或“否”);实验①中烧瓶内反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(4)实验②中,量气管中的液体最好是D:
A.H2O B.饱和NaHCO3溶液C.饱和Na2CO3溶液 D.CCl4
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②保持量气管内液体与干燥管内液体液面相平,③视线与凹液面最低处相平.
(6)实验③获得以下数据(所有气体体积均已换算成标准状况).
根据上述合理数据计算粗Mg中Mg的质量分数72%.
 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、浓HNO3 | H2O | |
| ② | CaO固体、浓氨水 | NH3 | |
| ③ | 粗镁、稀H2SO4 (足量)[杂质不与硫酸反应] | H2 | H2O |
(2)检查该装置的气密性的方法是:关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高,说明气密性良好.
(3)该同学认为实验①可通过收集测量NO2气体的体积,来探究Cu样品的纯度.请问是否可行否(填“是”或“否”);实验①中烧瓶内反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(4)实验②中,量气管中的液体最好是D:
A.H2O B.饱和NaHCO3溶液C.饱和Na2CO3溶液 D.CCl4
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②保持量气管内液体与干燥管内液体液面相平,③视线与凹液面最低处相平.
(6)实验③获得以下数据(所有气体体积均已换算成标准状况).
| 编号 | 镁(含杂质)质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 0.5g | 10.0mL | 346.5mL |
| 2 | 0.5g | 10.0mL | 335.0mL |
| 3 | 0.5g | 10.0mL | 345.5mL |
11.下列装置所示的实验中,能达到实验目的是( )
| A. | 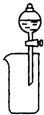 CCl4萃取I2后从下口放出水层 | B. | 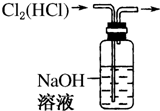 除去Cl2中的HCl | ||
| C. | 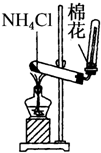 实验室制氨气 | D. | 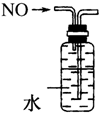 排水法收集NO |
18.下列除杂方法错误的是( )
| A. | NO中含有NO2,用水洗涤后再干燥 | |
| B. | CO2中含有SO2,通入饱和NaHCO3溶液后干燥 | |
| C. | NH3中含有H2O,用CaCl2进行干燥 | |
| D. | SO2中含有HCl,通入饱和NaHSO3溶液后干燥 |
 .
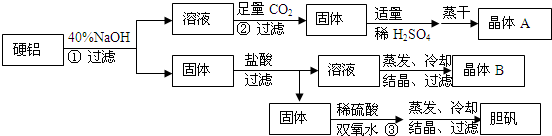
.
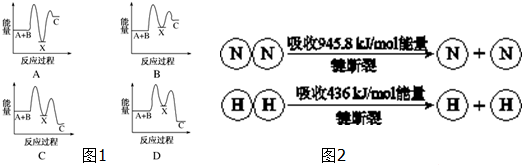
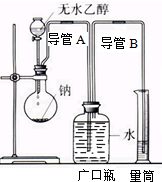 为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题:
为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题: