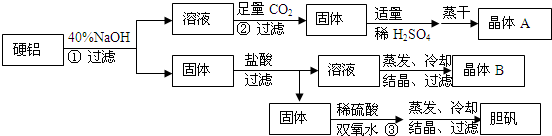
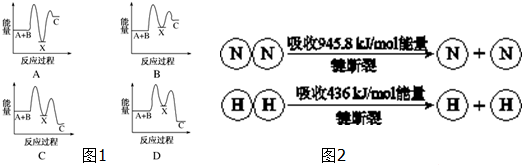
题目内容
3.写出下列反应的离子方程式①铜与稀硝酸反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
②将少量氯气通入FeBr2溶液中2Fe2++Cl2═2Fe3++2Cl-
③漂白粉溶液置于空气中变质Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO
④碳酸氢铵浓溶液与足量Ba(OH)2浓溶液混合共热NH4++HCO3-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaCO3↓+NH3↑+2H2O
⑤将SO2气体通入FeCl3溶液中2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
分析 ①发生氧化还原反应生成硝酸铜、NO和水;
②少量氯气,只氧化亚铁离子;
③与水、二氧化碳反应生成碳酸钙、HClO;
④反应生成碳酸钡、氨气、水;
⑤反应生成硫酸亚铁和盐酸.
解答 解:①发生氧化还原反应生成硝酸铜、NO和水,离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②少量氯气,只氧化亚铁离子,则将少量氯气通入FeBr2溶液中的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
③与水、二氧化碳反应生成碳酸钙、HClO,则漂白粉溶液置于空气中变质的离子反应为Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO,
故答案为:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO;
④反应生成碳酸钡、氨气、水,则碳酸氢铵浓溶液与足量Ba(OH)2浓溶液混合共热的离子反应为NH4++HCO3-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaCO3↓+NH3↑+2H2O,
故答案为:NH4++HCO3-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaCO3↓+NH3↑+2H2O;
⑤反应生成硫酸亚铁和盐酸,则将SO2气体通入FeCl3溶液中的离子反应为2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,故答案为:2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
点评 本题考查离子反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意氢氧化铝不溶于弱碱,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 砷在通常状况下是固体 | B. | 可以有-3、+3、+5等多种化合价 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 砷的还原性比磷弱 |
| A. |  CCl4萃取I2后从下口放出水层 | B. | 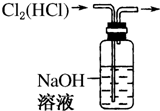 除去Cl2中的HCl | ||
| C. | 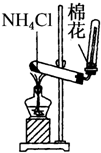 实验室制氨气 | D. | 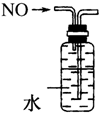 排水法收集NO |
| A. | NO中含有NO2,用水洗涤后再干燥 | |
| B. | CO2中含有SO2,通入饱和NaHCO3溶液后干燥 | |
| C. | NH3中含有H2O,用CaCl2进行干燥 | |
| D. | SO2中含有HCl,通入饱和NaHSO3溶液后干燥 |
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 铅蓄电池工作一段时间后酸性会增强 | |
| C. | 水和水煤气都是一级能源 | |
| D. | 铁与H2SO4反应时,加入少量CuSO4溶液时,可使反应加速 |
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性强弱:KOH>NaOH>LiOH |
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | ①②③④ | B. | 只有①②④ | C. | 只有②③④ | D. | 只有①②③ |