题目内容
4. 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
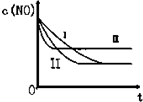
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
分析 (1)依据题干热化学方程式和盖斯定律计算得到所需热化学方程式,得到反应焓变;
(2)①随反应的进行深度减小,速率降低,根据3s时的浓度来求解;
②化学反应速率=$\frac{△c}{△t}$计算v(NO)的反应速率,结合反应速率之比等于化学方程式计量数之比计算v(CO2);
③利用化学平衡状态的特征判断,平衡的标志是正逆反应速率相同,各组分含量保持不变,以及衍生出的结论;
(3)利用影响化学反应速率及化学平衡的因素来分析;
(4)CO~2Ag,求平衡时一氧化碳的量,结合化学平衡三段式列式计算平衡浓度,再根据化学平衡常数表达式代入;
(5)①列三段表示出实验1各物质浓度的变化情况,然后根据速率公式:v(CO2)=$\frac{△c(C{O}_{2})}{△t}$,第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,说明该反应正向是放热反应;
②依据平衡常数不变列式计算c,反应物有两种或两种以上,增大一种反应物的量可以提高另一种反应物的转化率.
解答 解:(1)①2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol
②2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
③C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则依据盖斯定律计算③×2-②-①得到:N2(g)+O2(g)=2NO(g)△H=+180.5KJ/mol,
故答案为:+180.5;
(2)①因为3s,NO浓度为1.5,所以2s时,浓度变化量小于3,只有2.5符合,故选C;
②2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol,反应是气体体积减小的放热反应;
a.2v正(CO)=v逆(N2),速率之比,不等计量数之比,故a错误;
b.容器中混合气体的密度保持不变,始终不变,故b错误;
c.容器中气体的压强不变,说明气体的物质的量不变,故c正确;
d.CO2的体积分数不变,说明二氧化碳的量不变,故d正确;
故选:ab;
(3)由于②、③温度相同,催化剂对平衡移动无影响,化学平衡不移动,达到相同的平衡状态,但②的起始浓度较大,催化剂的比表面积较大,则反应的速率大,所以②先达到化学平衡,则Ⅰ为③,Ⅱ为②的图象,而①的温度高,则反应速率最大且平衡向着逆向移动,即达到化学平衡时c(NO)增大,则①对应Ⅲ图象,
故答案为:③;
(4)CO~2Ag
1 2×108g
x 43.2g
解得:x=0.2mol
2NO(g)+2CO(g)?2CO2(g)+N2(g)
初始量(mol/L):1 1 0 0
变化量(mol/L):0.8 0.8 0.8 0.4
平衡量(mol/L):0.2 0.2 0.8 0.4
所以K=$\frac{0.{8}^{2}×0.4}{0.{2}^{2}×0.{2}^{2}}$=160,故答案为:160;
(5)①H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化 0.8mol/L 0.8mol/l 0.8mol/L 0.8mol/L
平衡 0.2mol/L 1.2mol/L 0.8mol/L 0.8mol/L
v(CO2)=$\frac{△c(C{O}_{2})}{△t}$=$\frac{0.8mol/L}{5min}$=0.16mol/(L•min);
根据表中数据第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,说明该反应正向是放热反应,升高温度,K减小;
故答案为:0.16mol/(L•min);减小;
②900°C H2O(g)+CO(g)=CO2(g)+H2(g)
初始 0.5 mol/L 1mol/L 0 0
转化 0.2mol/L 0.2mol/l 0.2mol/L 0.2mol/L
平衡 0.3mol/L 0.8mol/L 0.2mol/L 0.2mol/L
K=$\frac{0.2×0.2}{0.3×0.8}$=$\frac{1}{6}$
900°C H2O(g)+CO(g)=CO2(g)+H2(g)
初始 1 mol/L 0.5mol/L 0 0
转化( 0.5-0.5c)mol/L (0.5-0.5c)mol/l (0.5-0.5c)mol/l (0.5-0.5c)mol/l
平衡 (0.5+05c)mol/l 0.5cmol/L (0.5-0.5c)mol/l (0.5-0.5c)mol/l
$\frac{(0.5-0.5a)^{2}}{(0.5+0.5a)0.5a}$
a=0.6mol,
反应物有两种或两种以上,增大一种反应物的量可以提高另一种反应物的转化率,a2(H2O)>a3(H2O),
故答案为:0.6;>.
点评 本题考查热化学方程式书写和计算、化学平衡和化学反应速率的计算等知识,注意元素守恒思想的灵活应用,注意一下化学平衡影响因素的分析判断,难度中等.

| A. | 在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA | |
| C. | 1.0 L的0.1 mol•L-1Na2S溶液中含有的S2-数为0.1NA | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
| A. | 5s | B. | 2d | C. | 3 f | D. | 1p |
| A. | 1:1 | B. | 10:1 | C. | <10:1 | D. | >10:1 |
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 水汽化需要吸收能量,所以水汽化属于吸热反应 | |
| C. | 所有的化合反应都是放热反应 | |
| D. | 1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
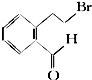 下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图:
下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图: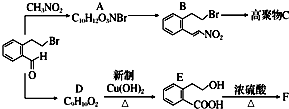
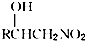
 .
.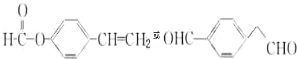 .
.
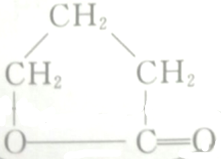 的各步反应方程式:
的各步反应方程式: