题目内容
16.2-(2-溴乙基)苯甲醛是一种重要的化工原料,结构简式如图所示: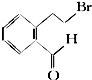 下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图:
下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图: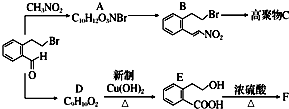
已知反应:R-CHO+CH3NO2→
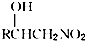
(1)2-(2-溴乙基)苯甲醛的分子式为C9H9OBr.
(2)2-(2-溴乙基)苯甲醛生成A的反应类型是加成反应,反应物CH3NO2的名称是硝基甲烷.
(3)A、D两种物质含有的相同的含氧官能团是羟基.
(4)由B生成C的化学方程式为
 .
.(5)若1个E分子生成1个F分子的过程中生成1个水分子,则F的结构简式有2种,有机化合物H与F是同分异构体,且H满足下列条件:
①能发生银镜反应;②不能与钠反应;③苯环上只有两个取代基;④有5种不同的氢原子.由此可推知H的结构简式为
 .
.
分析 根据2-(2-溴乙基)苯甲醛结构简式知,其分子式为C9H9OBr,根据题给信息知,2-(2-溴乙基)苯甲醛发生加成反应生成A,A结构简式为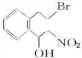 ,A消去反应生成B,B发生加聚反应生成C,C结构简式为
,A消去反应生成B,B发生加聚反应生成C,C结构简式为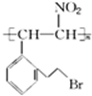 ;
;
根据D分子式知,2-(2-溴乙基)苯甲醛发生取代反应生成D,D结构简式为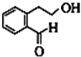 ,D和新制氢氧化铜悬浊液发生氧化反应生成E,E发生酯化反应生成F,若1个E分子生成1个F分子的过程中生成1个水分子,可以是分子间酯化反应、也可能是分子内酯化反应,还可以是发生消去反应,所以F有3种同分异构体,据此分析解答.
,D和新制氢氧化铜悬浊液发生氧化反应生成E,E发生酯化反应生成F,若1个E分子生成1个F分子的过程中生成1个水分子,可以是分子间酯化反应、也可能是分子内酯化反应,还可以是发生消去反应,所以F有3种同分异构体,据此分析解答.
解答 解:根据2-(2-溴乙基)苯甲醛结构简式知,其分子式为C9H9OBr,根据题给信息知,2-(2-溴乙基)苯甲醛发生加成反应生成A,A结构简式为 ,A消去反应生成B,B发生加聚反应生成C,C结构简式为
,A消去反应生成B,B发生加聚反应生成C,C结构简式为 ;
;
根据D分子式知,2-(2-溴乙基)苯甲醛发生取代反应生成D,D结构简式为 ,D和新制氢氧化铜悬浊液发生氧化反应生成E,E发生酯化反应生成F,若1个E分子生成1个F分子的过程中生成1个水分子,可以是分子间酯化反应、也可能是分子内酯化反应,所以F有两种同分异构体,
,D和新制氢氧化铜悬浊液发生氧化反应生成E,E发生酯化反应生成F,若1个E分子生成1个F分子的过程中生成1个水分子,可以是分子间酯化反应、也可能是分子内酯化反应,所以F有两种同分异构体,
(1)通过以上分析知,2-(2-溴乙基)苯甲醛的分子式为C9H9OBr,
故答案为:C9H9OBr;
(2)2-(2-溴乙基)苯甲醛生成A的反应类型是加成反应,反应物CH3NO2的名称是硝基甲烷,
故答案为:加成反应;硝基甲烷;
(3)A结构简式为 ,D结构简式为
,D结构简式为 ,A、D两种物质含有的相同的含氧官能团是羟基,故答案为:羟基;
,A、D两种物质含有的相同的含氧官能团是羟基,故答案为:羟基;
(4)B发生加聚反应生成C,C结构简式为 ,由B生成C的化学方程式为
,由B生成C的化学方程式为 ,
,
故答案为: ;
;
(5)若1个E分子生成1个F分子的过程中生成1个水分子,可以是分子内酯化也可能是分子间酯化或发生消去反应,所以F的结构简式有3种,有机化合物H与F是同分异构体,且H满足下列条件:
①能发生银镜反应说明含有醛基;②不能与钠反应说明不含羟基、羧基;③苯环上只有两个取代基;④有5种不同的氢原子,由此可推知H的结构简式为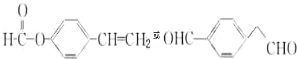 ,
,
故答案为: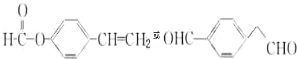 .
.
点评 本题考查有机物推断,为高考高频点,侧重考查学生分析推断能力,根据分子式、结构简式结合题给信息进行推断,知道常见有机化学反应类型及其反应条件,明确断键和成键方式、位置,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | ①④⑤⑥ | B. | ②③⑦⑧ | C. | ②④⑤⑥ | D. | ④⑤⑥⑧ |
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
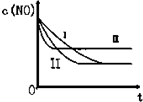
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
| A. | 烷烃与烯烃不可能是同分异构体 | |
| B. | 同分异构体只能存在于有机化合物之间 | |
| C. | 乙酸和甲酸甲酯不互为同分异构体 | |
| D. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 |
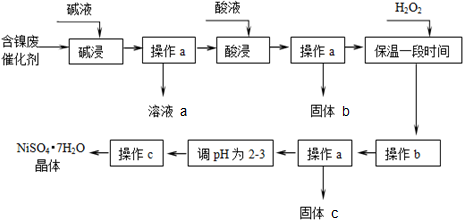
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝,聚合氯化铝是一种新型净水剂,其中铝主要以[AlO2Al12(OH)24•(H2O)12]2+(用Alx表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Aln含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24•(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层电子数是K层电子数的3倍 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有5个电子 |
 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.(2)Y元素最高价氧化物对应水化物的化学式Al(OH)3,该物质与NaOH溶液反应的化学方程式为Al(OH)3+OH-═[Al(OH)4]-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由是只有Al具有金属性.