题目内容
14.NA为阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA | |
| C. | 1.0 L的0.1 mol•L-1Na2S溶液中含有的S2-数为0.1NA | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
分析 A.合成氨为可逆反应;
B.求出钠的物质的量,然后根据钠元素的化合价变化来分析;
C.硫离子为弱酸根离子,存在水解;
D.气体摩尔体积适用对象为气体.
解答 解:A.合成氨为可逆反应,反应物不能完全转化为生成物,1.5 mol H2和0.5 mol N2,充分反应后得到NH3分子数小于NA,故A错误;
B.2.3g钠的物质的量为0.1mol,而钠无论反应后产物是什么,钠元素反应后一定变为+1价,故0.1mol钠失去0.1mol电子,故B正确;
C.硫离子为弱酸根离子,存在水解,所以1.0 L的0.1 mol•L-1Na2S溶液中含有的S2-数小于0.1NA,故C错误;
D.标况下,四氯化碳为液体,不能使用气体摩尔体积,故D错误.
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,注意盐类的水解,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
5.X元素原子的质量数为m,核内中子数为n,则X+的核外电子数为( )
| A. | m-n | B. | m+n | C. | m-n-1 | D. | m-n+1 |
2.往纯水中加入下列物质,能使水的电离平衡发生移动的是( )
| A. | NaCl | B. | NaOH | C. | 酒精 | D. | CH3COOH |
19.阿伏加德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A. | 标准状况下,2.24L苯中约含有3.612×1023个碳原子 | |
| B. | 常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子 | |
| C. | 1L 1mol/L醋酸溶液中离子总数为1.204×l024 | |
| D. | 0.5mol CH4中约含有3.01×1023个电子 |
3.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子存在非极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
4. 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
①c1合理的数值为C.(填字母标号)
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
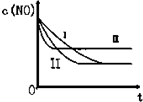
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为③.
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
①实验组①中以v(CO2)表示的反应速率为0.16mol/(L•min),温度升高时平衡常数会减小(填“增大”、“减小”或“不变”).
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).