题目内容
12.(1)如图1装置中,开始电解时,Al电极反应式为2Al-6e-=2Al3+,石墨电极反应式为6H++6e-=3H2↑.(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的图象2(反应物足量,作出标注).
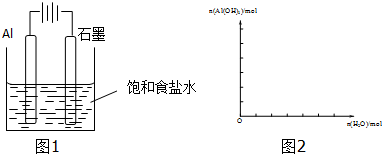
分析 (1)如图1装置为电解池,开始电解时,与电源正极相连的Al电极为阳极本身失电子发生氧化反应,与电源负极相连的石墨电极为阴极得电子发生还原反应;
(2)根据电解的阴阳极反应书写总反应为2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3+6H+,据此分析画图.
解答 解:(1)如图1装置为电解池,开始电解时,与 电源正极相连的Al电极为阳极,反应式为2Al-6e-=2Al3+,与电源负极相连的石墨电极为阴极,反应式为 6H++6e-=3H2↑;故答案为:2Al-6e-=2Al3+;6H++6e-=3H2↑;
(2)因为阳极反应式为2Al-6e-=2Al3+,阴极为反应式为 6H++6e-=3H2↑,则电解的总反应为2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3+6H+,所以有0.6mol电子转移,则生成Al(OH)3物质的量为0.2mol,消耗H2O的物质的量为0.6mol,所以Al(OH)3物质的量与消耗H2O的物质的量的图象为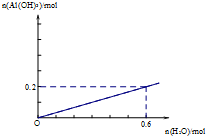 ,故答案为:
,故答案为: .
.
点评 本题主要考查了电解原理的分析应用,正确分析判断电极名称、电极反应和电极产物以及根据电子守恒进行计算是解题关键,题目难度中等.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
2.往纯水中加入下列物质,能使水的电离平衡发生移动的是( )
| A. | NaCl | B. | NaOH | C. | 酒精 | D. | CH3COOH |
3.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子存在非极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
7.硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]又称莫尔盐,是常用的分析试剂.实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体.为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+.滴定时必须选用的仪器有( )
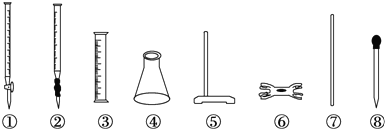

| A. | ①④⑤⑥ | B. | ②③⑦⑧ | C. | ②④⑤⑥ | D. | ④⑤⑥⑧ |
4. 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
①c1合理的数值为C.(填字母标号)
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
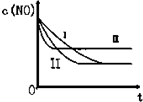
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为③.
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
①实验组①中以v(CO2)表示的反应速率为0.16mol/(L•min),温度升高时平衡常数会减小(填“增大”、“减小”或“不变”).
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
1.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备Ni SO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).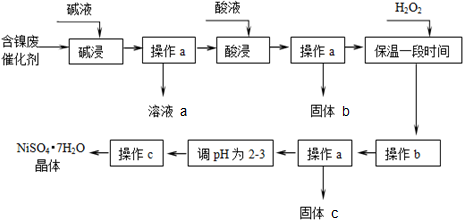
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a的名称是过滤.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝,聚合氯化铝是一种新型净水剂,其中铝主要以[AlO2Al12(OH)24•(H2O)12]2+(用Alx表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Aln含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24•(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝,聚合氯化铝是一种新型净水剂,其中铝主要以[AlO2Al12(OH)24•(H2O)12]2+(用Alx表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Aln含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24•(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
2.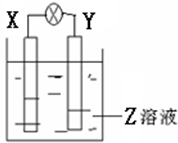 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )| X | Y | Z | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 锌 | 铜 | 硝酸银溶液 |
| D | 碳 | 锌 | 硝酸铜溶液 |
| A. | A | B. | B | C. | C | D. | D |
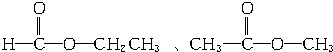 、
、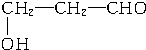 、
、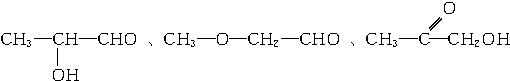 .
.