题目内容
14.写出以CH2ClCH2CH2CH2OH为原料制备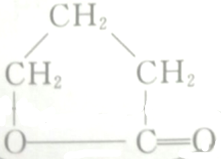 的各步反应方程式:
的各步反应方程式:①2CH2ClCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2ClCH2CH2CHO+2H2O、2CH2ClCH2CH2CHO+O2$→_{△}^{Cu}$2CH2ClCH2CH2COOH;
②CH2ClCH2CH2COOH+2NaOH→HOCH2CH2CH2COONa+NaCl+H2O;
③HOCH2CH2CH2COONa+HCl→HOCH2CH2CH2COOH+NaCl;
④HOCH2CH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$
 +H2O.
+H2O.
分析 制备 ,由逆合成法可知,需要HOCH2CH2CH2COOH,可由CH2ClCH2CH2CH2OH→CH2ClCH2CH2CHO→CH2ClCH2CH2COOH→HOCH2CH2CH2COOH→
,由逆合成法可知,需要HOCH2CH2CH2COOH,可由CH2ClCH2CH2CH2OH→CH2ClCH2CH2CHO→CH2ClCH2CH2COOH→HOCH2CH2CH2COOH→ 合成,以此来解答.
合成,以此来解答.
解答 解:合成流程为CH2ClCH2CH2CH2OH→CH2ClCH2CH2CHO→CH2ClCH2CH2COOH→HOCH2CH2CH2COOH→ ,发生的反应分别为
,发生的反应分别为
2CH2ClCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2ClCH2CH2CHO+2H2O、2CH2ClCH2CH2CHO+O2$→_{△}^{Cu}$2CH2ClCH2CH2COOH,
CH2ClCH2CH2COOH+2NaOH→HOCH2CH2CH2COONa+NaCl+H2O,
HOCH2CH2CH2COONa+HCl→HOCH2CH2CH2COOH+NaCl,
HOCH2CH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O,
+H2O,
故答案为:2CH2ClCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2ClCH2CH2CHO+2H2O、2CH2ClCH2CH2CHO+O2$→_{△}^{Cu}$2CH2ClCH2CH2COOH;CH2ClCH2CH2COOH+2NaOH→HOCH2CH2CH2COONa+NaCl+H2O;HOCH2CH2CH2COONa+HCl→HOCH2CH2CH2COOH+NaCl;HOCH2CH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.
点评 本题考查有机物的合成,为高频考点,把握逆合成法及合成反应中官能团的变化为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

练习册系列答案
相关题目
4. 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
①c1合理的数值为C.(填字母标号)
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
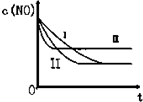
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为③.
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
①实验组①中以v(CO2)表示的反应速率为0.16mol/(L•min),温度升高时平衡常数会减小(填“增大”、“减小”或“不变”).
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20B.4.00C.3.50D.2.50
②不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v正(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)?2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为α2 (H2O)>
α3 (CO)(填“<”、“>”或“=”).
2.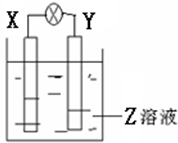 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )| X | Y | Z | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 锌 | 铜 | 硝酸银溶液 |
| D | 碳 | 锌 | 硝酸铜溶液 |
| A. | A | B. | B | C. | C | D. | D |
9.如图是四种短周期元素在元素周期表中的相对位置,其中X和Y原子的质子数之和为(10n+m)、Z和W原子的核外电子数之和为(10m+n)(m、n均为正整数).下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | X、Y、W三种元素的气态氢化物中,X的气态氢化物的水溶液碱性最强 | |
| B. | XW2的电子式为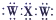 | |
| C. | 实验室制备YO2和WO2的发生装置都可用 | |
| D. | W和Y 的最高价氧化物对应的水化物的稀溶液溶解铁,表现出的性质相同 |
6.下表为部分短周期元素的性质或原子结构:
(1)写出元素X的离子结构示意图: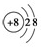 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.
(2)Y元素最高价氧化物对应水化物的化学式Al(OH)3,该物质与NaOH溶液反应的化学方程式为Al(OH)3+OH-═[Al(OH)4]-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由是只有Al具有金属性.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层电子数是K层电子数的3倍 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有5个电子 |
 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.(2)Y元素最高价氧化物对应水化物的化学式Al(OH)3,该物质与NaOH溶液反应的化学方程式为Al(OH)3+OH-═[Al(OH)4]-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由是只有Al具有金属性.
3.化合物A是一种热稳定性较差的无水的弱酸钠盐,用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果如表:利用上述信息,有关说法正确的是( )
| 样品中A的质量分数/% | 20 | 50 | 70 | 90 |
| 样品的质量损失/% | 7.4 | 18.5 | 25.9 | 33.3 |
| A. | 化合物A的摩尔质量为104g•mol-1 | |
| B. | 样品A的质量分数为55%,加热至400℃样品质量损失21.35% | |
| C. | 样品A加热后的气体能使品红褪色 | |
| D. | 16.8g化合物A加热至质量不变化后,剩余固体质量为10.6g |
1.下列说法正确的是( )
| A. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| B. | 桶烯(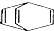 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 | |
| C. | 1.0mol的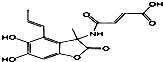 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol | |
| D. | 按系统命名法,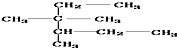 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 |