题目内容
复分解反应是中学化学中常见的一种反应类型.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O.若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质.
(1)依照该规律,请判断下列反应不能成立的是 (填字母序号).
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CH3COOH+NaCN═CH3COONa+HCN
(2)根据上述信息判断,常温下浓度均为0.05mol/L的下列溶液中,pH最小的是 (填序号),其pH为 (填数值).
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)上述(2)中五种溶液都会对水的电离产生影响,由水电离出的H+浓度由大到小的顺序为 (填序号)
(4)下列有关0.1mol?L-1 NaHCO3溶液中离子浓度的关系式,正确的是
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| PH | 8.1 | 8.4 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)依照该规律,请判断下列反应不能成立的是
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CH3COOH+NaCN═CH3COONa+HCN
(2)根据上述信息判断,常温下浓度均为0.05mol/L的下列溶液中,pH最小的是
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)上述(2)中五种溶液都会对水的电离产生影响,由水电离出的H+浓度由大到小的顺序为
(4)下列有关0.1mol?L-1 NaHCO3溶液中离子浓度的关系式,正确的是
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,探究化学规律
专题:实验设计题,基本概念与基本理论
分析:(1)表格中均为强碱弱酸盐,水解显碱性,pH越大,则对应的酸的酸性越弱,则酸性CH3COOH>H2CO3>HClO>HCN>C6H5OH>HCO3-,结合选项利用强酸制取弱酸的反应原理来分析;
(2)高氯酸和硫酸是强酸,在水溶液里完全电离,相同浓度的不同酸,氢离子浓度越大其pH越小;
(3)酸或碱都抑制水电离,酸溶液中氢离子浓度越大,其抑制水电离程度越大;
(4)碳酸氢钠为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致其溶液呈碱性,溶液中存在电荷守恒和物料守恒.
(2)高氯酸和硫酸是强酸,在水溶液里完全电离,相同浓度的不同酸,氢离子浓度越大其pH越小;
(3)酸或碱都抑制水电离,酸溶液中氢离子浓度越大,其抑制水电离程度越大;
(4)碳酸氢钠为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致其溶液呈碱性,溶液中存在电荷守恒和物料守恒.
解答:
解:(1)表格中均为强碱弱酸盐,水解显碱性,pH越大,则对应的酸的酸性越弱,则酸性CH3COOH>H2CO3>HClO>HCN>C6H5OH>HCO3-,
A.酸性HClO>HCO3-,所以发生反应CO2+H2O+NaClO═NaHCO3+HClO,故不成立;
B.酸性H2CO3>HClO>HCO3-,所以发生反应CO2+H2O+NaClO═NaHCO3+HClO,故成立;
C.酸性CH3COOH>H2CO3>HClO>HCN,所以发生反应CH3COOH+NaCN═CH3COONa+HCN,故成立;
故选A;
(2)高氯酸和硫酸是强酸,在水溶液里完全电离,相同浓度的不同酸,氢离子浓度越大其pH越小,HCN、醋酸、HClO都是弱酸,溶液中氢离子浓度小于0.05mol/L,高氯酸溶液中氢离子浓度为0.05mol/L,硫酸中氢离子浓度为0.1mol/L,所以这几种酸中硫酸中氢离子浓度最大,pH=1,故答案为:⑤;1;
(3)酸或碱都抑制水电离,酸溶液中氢离子浓度越大,其抑制水电离程度越大,这几种酸溶液中酸电离出氢离子浓度大小顺序是①<④<②<③<⑤,所以水电离出氢离子浓度大小顺序是①>④>②>③>⑤;
(4)碳酸氢钠为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致其溶液呈碱性,
A.HCO3-水解程度大于电离程度导致其溶液呈碱性,但水解和电离程度较小,钠离子不水解,碳酸氢根离子和水都电离出氢离子,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故正确;
B.HCO3-水解程度大于电离程度导致其溶液呈碱性,但水解和电离程度较小,所以c(CO32-)<c(HCO3-),故错误;
C.根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故正确;
D.根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故正确;
故选ACD.
A.酸性HClO>HCO3-,所以发生反应CO2+H2O+NaClO═NaHCO3+HClO,故不成立;
B.酸性H2CO3>HClO>HCO3-,所以发生反应CO2+H2O+NaClO═NaHCO3+HClO,故成立;
C.酸性CH3COOH>H2CO3>HClO>HCN,所以发生反应CH3COOH+NaCN═CH3COONa+HCN,故成立;
故选A;
(2)高氯酸和硫酸是强酸,在水溶液里完全电离,相同浓度的不同酸,氢离子浓度越大其pH越小,HCN、醋酸、HClO都是弱酸,溶液中氢离子浓度小于0.05mol/L,高氯酸溶液中氢离子浓度为0.05mol/L,硫酸中氢离子浓度为0.1mol/L,所以这几种酸中硫酸中氢离子浓度最大,pH=1,故答案为:⑤;1;
(3)酸或碱都抑制水电离,酸溶液中氢离子浓度越大,其抑制水电离程度越大,这几种酸溶液中酸电离出氢离子浓度大小顺序是①<④<②<③<⑤,所以水电离出氢离子浓度大小顺序是①>④>②>③>⑤;
(4)碳酸氢钠为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致其溶液呈碱性,
A.HCO3-水解程度大于电离程度导致其溶液呈碱性,但水解和电离程度较小,钠离子不水解,碳酸氢根离子和水都电离出氢离子,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故正确;
B.HCO3-水解程度大于电离程度导致其溶液呈碱性,但水解和电离程度较小,所以c(CO32-)<c(HCO3-),故错误;
C.根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故正确;
D.根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故正确;
故选ACD.
点评:本题考查了离子浓度大小比较、弱电解质的电离及盐类水解,明确酸的强弱与酸根离子水解程度大小之间的关系是解本题关键,再结合守恒思想分析解答,题目难度中等.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
实验室用于检验盐酸和其他电离时能产生Cl-的化合物的试剂是( )
| A、稀盐酸和石灰水 |
| B、氢氧化铁 |
| C、氯化钡溶液和稀硝酸 |
| D、硝酸银溶液和稀硝酸 |
 ,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为:
,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为: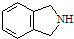 与
与 也可以发生类似反应①的反应,参加反应的分子数为2:1,则生成的产物的结构简式为
也可以发生类似反应①的反应,参加反应的分子数为2:1,则生成的产物的结构简式为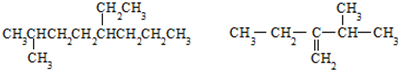
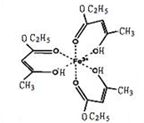 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.