��Ŀ����
�ڶ�����Ӧ��ż����Ӧ��һ�֣�����ʵ��±�����뺬���ӻ��ķ�Ӧ�����磺
��Ӧ��
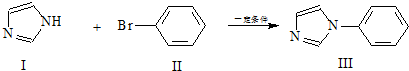
��1���������ķ���ʽΪ ��
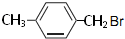
��2����������ǻ�������ͬϵ�����ʽΪC8H9Br����Ϊ���Ķ�λ��ȡ�����˴Ź�������ͼ����4��壬�������Ϊ2��2��2��3����ṹ��ʽΪ ����дһ�֣���
��3��1mol������������ mol H2�����ӳɷ�Ӧ������ṹ��ʽΪ ��
��4�����������һ��ͬ���칹����Ľṹ��ʽΪ �������������ƴ���Һ���������·�Ӧ�ķ���ʽΪ�� ��
�������������ƴ���Һ���������·�Ӧ�ķ���ʽΪ�� ��
��5��һ�������£�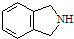 ��
�� Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ���μӷ�Ӧ�ķ�����Ϊ2��1�������ɵIJ���Ľṹ��ʽΪ ��
Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ���μӷ�Ӧ�ķ�����Ϊ2��1�������ɵIJ���Ľṹ��ʽΪ ��
��Ӧ��
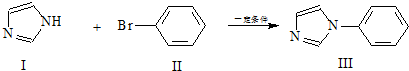
��1���������ķ���ʽΪ
��2����������ǻ�������ͬϵ�����ʽΪC8H9Br����Ϊ���Ķ�λ��ȡ�����˴Ź�������ͼ����4��壬�������Ϊ2��2��2��3����ṹ��ʽΪ
��3��1mol������������
��4�����������һ��ͬ���칹����Ľṹ��ʽΪ
 �������������ƴ���Һ���������·�Ӧ�ķ���ʽΪ��
�������������ƴ���Һ���������·�Ӧ�ķ���ʽΪ����5��һ�������£�
 ��
�� Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ���μӷ�Ӧ�ķ�����Ϊ2��1�������ɵIJ���Ľṹ��ʽΪ
Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ���μӷ�Ӧ�ķ�����Ϊ2��1�������ɵIJ���Ľṹ��ʽΪ���㣺�л���Ľṹ������
ר�⣺�л���Ļ�ѧ���ʼ��ƶ�
��������1�����ݽṹ��ʽȷ���л��ﺬ�е�Ԫ�������ԭ�Ӹ�������ȷ����ѧʽ��
��2����������ǻ�������ͬϵ�����ʽΪC8H9Br����Ϊ���Ķ�λ��ȡ�����˴Ź�������ͼ����4��壬�������Ϊ2��2��2��3��Ӧ����4�ֲ�ͬ��H��
��3�����������̼̼˫���ͱ��������������������ӳɷ�Ӧ��
��4�������������ƴ���Һ��������д�ɷ�����ȥ��Ӧ��
��5���������Ϣ��֪�γ�N-C����
��2����������ǻ�������ͬϵ�����ʽΪC8H9Br����Ϊ���Ķ�λ��ȡ�����˴Ź�������ͼ����4��壬�������Ϊ2��2��2��3��Ӧ����4�ֲ�ͬ��H��
��3�����������̼̼˫���ͱ��������������������ӳɷ�Ӧ��
��4�������������ƴ���Һ��������д�ɷ�����ȥ��Ӧ��
��5���������Ϣ��֪�γ�N-C����
���
�⣺��1���ɽṹ��ʽ��֪�л������ʽΪC3H4N2���ʴ�Ϊ��C3H4N2��
��2����������ǻ�������ͬϵ�����ʽΪC8H9Br����Ϊ���Ķ�λ��ȡ�����˴Ź�������ͼ����4��壬�������Ϊ2��2��2��3��Ӧ����4�ֲ�ͬ��H������Ϊ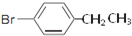 ��
��  ��
��
�ʴ�Ϊ�� ��
��  ��
��
��3�����������̼̼˫���ͱ��������������������ӳɷ�Ӧ������Ҫ5mol��������Ӧ�IJ���Ϊ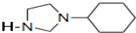 ��
��
�ʴ�Ϊ��5��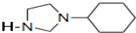 ��
��
��4�������������ƴ���Һ��������д�ɷ�����ȥ��Ӧ������ʽΪ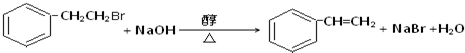 ��
��
�ʴ�Ϊ�� ��
��
��5���������Ϣ��֪�γ�N-C��������Ϊ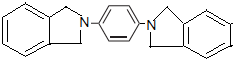 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2����������ǻ�������ͬϵ�����ʽΪC8H9Br����Ϊ���Ķ�λ��ȡ�����˴Ź�������ͼ����4��壬�������Ϊ2��2��2��3��Ӧ����4�ֲ�ͬ��H������Ϊ
 ��
��  ��
���ʴ�Ϊ��
 ��
��  ��
����3�����������̼̼˫���ͱ��������������������ӳɷ�Ӧ������Ҫ5mol��������Ӧ�IJ���Ϊ
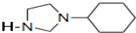 ��
���ʴ�Ϊ��5��
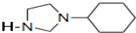 ��
����4�������������ƴ���Һ��������д�ɷ�����ȥ��Ӧ������ʽΪ
 ��
���ʴ�Ϊ��
 ��
����5���������Ϣ��֪�γ�N-C��������Ϊ
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���������⿼���л���Ľṹ�����ʣ�Ϊ��Ƶ����ͳ������ͣ�������ѧ���ķ��������Ŀ��飬ע������л���Ľṹ�����ŵ����ʣ�Ϊ������Ĺؼ�������ע��ͬ���칹����жϣ�

��ϰ��ϵ�д�
 ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
�����Ŀ
���з�Ӧ����������ԭ��Ӧ��������������������ڷ�Ӧ������������ǣ�������
| A��п����ϡ����ķ�Ӧ |
| B��Ba��OH��2��Һ�����ᷴӦ |
| C�������������е�ȼ�շ�Ӧ |
| D�����ȵ�ľ̿��CO2��Ӧ |
���ۼ������Ӽ��ͷ��»�������������֮��IJ�ͬ���������������ʣ���Na2O2����SiO2���۵⣻�ܽ��ʯ����NaCl���ް��ף����к�������������������ǣ�������
| A���٢ڢ� | B���٢ۢ� |
| C���ڢܢ� | D���٢ڢۢ� |
�ڶ�����Ԫ�أ��������γ�X2O5�����й�X��������ȷ���ǣ�������
| A��X�ĵ����ڳ������Է��Ӿ�����ʽ���� |
| B��X2O5��ˮ������һ��ǿ�� |
| C��X���⻯���ڹ�̬�������Ӿ��� |
| D��X������Ԫ�صĵ����ڹ�̬ʱ������ͬһ�������� |
���л�ѧʵ��������������ȷ���ǣ�������
| A������ʹʪ��ĺ�ֽ����ɫ |
| B��ʯ����Һ����ϡ������Һ���Ժ�ɫ |
| C��������Һ����Ʊ���ɫ |
| D��������ͭ��Һ�еμ�����������Һ���ֺ��ɫ���� |