题目内容
14.下列说法正确的是( )| A. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热--检验混合物中是否含有甲醛 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
分析 A.甲酸含有醛基,可与新制的氢氧化铜发生氧化还原反应;
B.CH3CH2Br为非电解质,不能发生电离,则不能直接加入硝酸银检验;
C.苯和四氯化碳互溶;
D.CH3OCH3和CH3CH2OH含有的等效氢原子数目不同.
解答 解:A.甲酸含有醛基,可与新制的氢氧化铜发生氧化还原反应,不能直接检验,故A错误;
B.CH3CH2Br为非电解质,不能发生电离,则不能直接加入硝酸银检验,应先在碱性条件下水解,加入硝酸酸化后再加入硝酸银溶液检验,故B错误;
C.苯和四氯化碳互溶,可用蒸馏的方法分离四氯化碳和溴,故C错误;
D.CH3OCH3含有1种H原子,而CH3CH2OH含有3种氢原子,数目不同,可用核磁共振氢谱检验,故D正确.
故选D.
点评 本题考查较为综合,涉及有机物的检验、鉴别和分离等知识,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握有机物性质的异同,难度不大.

练习册系列答案
相关题目
2.化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO $\frac{\underline{\;\;△\;\;}}{\;}$ 3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+2O2↑
下列说法正确是( )
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO $\frac{\underline{\;\;△\;\;}}{\;}$ 3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+2O2↑
下列说法正确是( )
| A. | 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 | B. | 还原性(碱性溶液):Fe(OH)2>I2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO>NaClO4 | D. | 酸性(水溶液):H2CO3>HSCN>HCN |
6.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | Mg3N2+H2O═3Mg(OH)2+2NH3↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | 2NaOH+Cl2═NaCl+NaClO+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
4.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应可以设计成原电池来提供电能 |
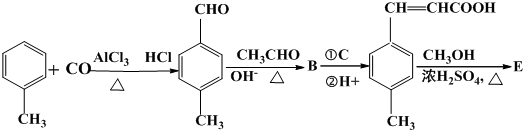
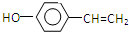 ;
;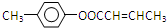 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为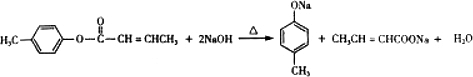 .
.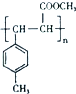 .
.
 所示.下列关于有机物 I的说法正确的是CD.
所示.下列关于有机物 I的说法正确的是CD.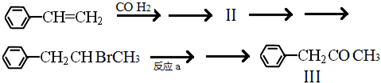
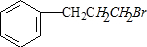 ;
; ;
; +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr.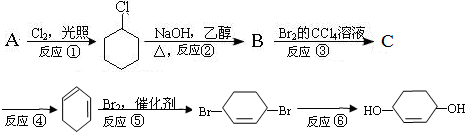
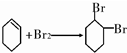
 .
.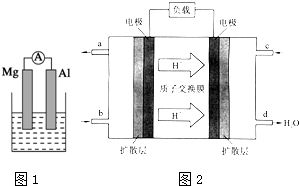 据图回答下列问题:
据图回答下列问题: