题目内容
19.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )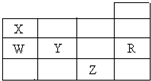
| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性高 | |
| D. | Y元素的非金属性比W元素的非金属性强 |
分析 由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.根据物质的在常压下的存在形式分析,常压下S、P为固体,而Br为液体;
B.Y的阴离子核外有18个电子,Z的阴离子核外有36个电子,以此进行分析;
C.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
D.同周期从左到右元素的非金属性逐渐增强.
解答 解:由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.常温下氮气、氩为气体,磷、硫为固体,而溴为液,故溴的沸点不是最高的,故A错误;
B.Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误;
C.同主族自上而下非金属性减弱,非金属性X>W,非金属性越强,氢化物越稳定,故氢化物稳定性X>W,故C错误;
D.同周期从左到右元素的非金属性逐渐增强,故金属性非金属性Y>W,故D正确,
故选D.
点评 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.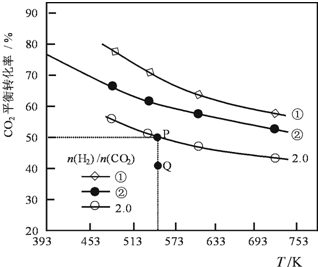 在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
 在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 氢碳比:①<② | |
| C. | 在氢碳比为2.0时,Q点v(正)<v(逆) | |
| D. | 若起始时,CO2、H2浓度分别为0.5mol•L-1和1.0mol•L-1,则可得P点对应温度的平衡常数的值为512 |
10.下列说法不正确的是( )
| A. | 豆科植物通过根瘤菌吸收空气中的氮是化学变化 | |
| B. | 化石燃料燃烧通常不释放出氮氧化合物 | |
| C. | 汽车尾气中排放的氮氧化合物是由游离态氮转化来的 | |
| D. | 植物秸秆燃烧时放出氮氧化合物,参与了氮的循环 |
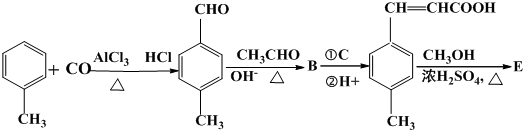
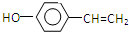 ;
;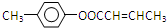 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为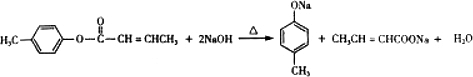 .
. .
. 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题: .
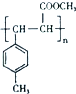
. 所示.下列关于有机物 I的说法正确的是CD.
所示.下列关于有机物 I的说法正确的是CD.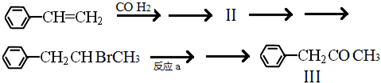
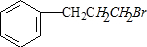 ;
; ;
; +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr.