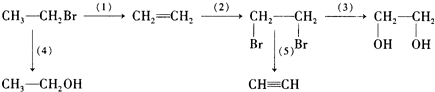
题目内容
3.有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③.甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量.(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为6.0g.
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊.再将反应后的固体与足量的稀硝酸微热,充分反应后,有bg固体剩余,该剩余固体的化学式为C.样品②中氧化铜质量为$\frac{20(a-b)}{23}$g
(以含a、b的代数式表示).
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为$\frac{c}{28}$mol≤n(CuO)≤$\frac{c}{22}$mol.
分析 (1)Cu和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的气体是NO,n(NO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据转移电子相等计算n(Cu),再根据Cu原子守恒计算n(CuO)、m=nM计算氧化铜的质量;
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊,说明生成的气体是CO而不是CO2,则C过量、CuO不足量,Cu和稀硝酸反应、C和稀硝酸不反应,所以bg固体是C,参加反应的CuO和C的质量=(a-b)g,二者反应方程式为CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑,根据方程式计算CuO的质量;
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,减少的质量为O、C的质量,生成的气体可能是CO或CO2,采用极值法结合关系式计算CuO的物质的量.
解答 解:(1)Cu和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的气体是NO,n(NO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据转移电子相等得n(Cu)=$\frac{0.05mol×(5-2)}{2-0}$=0.075mol,根据Cu原子守恒得n(CuO)=n(Cu)=0.075mol,m(CuO)=0.075mol×80g/mol=6.0g,
故答案为:6.0;
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊,说明生成的气体是CO而不是CO2,则C过量、CuO不足量,Cu和稀硝酸反应、C和稀硝酸不反应,所以bg固体是C,参加反应的CuO和C的质量=(a-b)g,二者反应方程式为CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑,
设CuO的质量为x,
CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑ (CuO+C)
80 92
x (a-b)g
80:92=x:(a-b)g
x=$\frac{(a-b)g×80}{92}$=$\frac{20(a-b)}{23}$,
故答案为:C;$\frac{20(a-b)}{23}$;
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,减少的质量为O、C的质量,生成的气体可能是CO或CO2,
CuO+C$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑
2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,
假设生成的气体是CO,根据方程式得n(CuO)=n(CO)=$\frac{cg}{28g/mol}$=$\frac{c}{28}$mol,
假设生成的气体是CO2,根据方程式得n(CuO)=2n(CO2)=2×$\frac{cg}{44g/mol}$=$\frac{c}{22}$mol,
实际上生成的气体介于二者之间,所以$\frac{c}{28}$mol≤n(CuO)≤$\frac{c}{22}$mol,
故答案为:$\frac{c}{28}$mol≤n(CuO)≤$\frac{c}{22}$mol.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确反应前后改变的物理量成分是解本题关键,难点是(3)题采用极值法分析解答,题目难度中等.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案| A. | 所有的非金属元素都分布在P区 | |
| B. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| C. | 原子的核外电子层数等于该元素所在的周期数 | |
| D. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
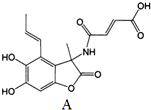
| A. | 化合物M的分子式为C16H15NO7 | |
| B. | 1 mol M在NaOH溶液中反应,最多消耗4 mol NaOH | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 化合物M能使酸性KMnO4溶液褪色 |
| A. | 4.4g乙醛分子中含有的共用电子对数为0.6NA | |
| B. | 标准状况下,11.2L二氯甲烷所含分子数为0.5NA | |
| C. | 15.6g苯中含有碳碳双键的个数为0.6NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
①Cu ②Cu(NO3)2 ③HNO3 ④Zn(NO3)2( )
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
| A. | 粗铜接电源的正极 | |
| B. | 电解一段时间后,溶液中Cu2+减小 | |
| C. | 若电路中通过1 mol电子,有0.5 mol铜被氧化 | |
| D. | 阴极反应只有Cu2++2e-→Cu |
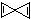 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境只有一种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |