题目内容
8.将Cu、Zn混合物投入稀HNO3中,充分反应后,锌有剩余,则反应后的肯定不存在的是①Cu ②Cu(NO3)2 ③HNO3 ④Zn(NO3)2( )
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
分析 Zn比Cu活泼,将一定量Cu、Zn混合物加入稀HNO3溶液中,首先是较活泼的锌与酸溶液反应,当锌完全反应后,才能与铜反应,以此解答该题.
解答 解:①因为锌有剩余,所以存在铜.②铜没有参加反应,所以无Cu(NO3).③有锌剩,所以无硝酸.④锌参加反应,所以有硝酸锌.故选B.
点评 本题考查金属的活泼性比较以及硝酸的化学性质,题目难度较大,注意把握金属的活泼性强弱的比较,题目难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
16.把质量为m g的铜丝灼烧变黑,立即放入下列物质中,使铜丝变红,而且质量仍为m g的是( )
| A. | H2SO4 | B. | C2H5OH | C. | 稀HNO3 | D. | NaOH溶液 |
13.下列关于乙炔制取的说法不正确的是( )
| A. | 为了减慢反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 为了除去杂质气体,可用硫酸铜溶液 | |
| D. | 反应中需加碎瓷片作沸石 |
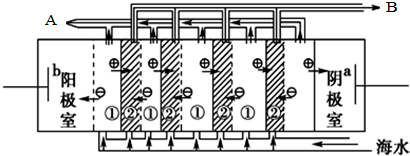
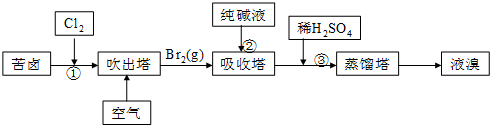

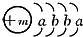 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.



 .
.