题目内容
15.可用电解法将粗铜变为精铜,粗铜作阳极,精铜作阴极,足量硫酸铜溶液作电解液.粗铜在阳极的反应顺序是:Fe-2e-→Fe2+、Ni-2e-→Ni2+、Cu-2e-→Cu2+,杂质金和银不反应形成“阳极泥”.则以下叙述错误的是( )| A. | 粗铜接电源的正极 | |
| B. | 电解一段时间后,溶液中Cu2+减小 | |
| C. | 若电路中通过1 mol电子,有0.5 mol铜被氧化 | |
| D. | 阴极反应只有Cu2++2e-→Cu |
分析 A.电解法精炼铜,粗铜做阳极发生氧化反应,精铜做阴极发生还原反应;
B.阴极上溶液中的铜离子得到电子发生还原反应在阴极析出;
C.粗铜中含有铁、镍等活泼性强于铜的金属,先于铜放电;
D.阴极上溶液中的铜离子得到电子发生还原反应.
解答 解:A.电解法精炼铜,粗铜做阳极连接电源正极,精铜做阴极连接电源负极,故A正确;
B.溶液中的铜离子在阴极得到电子发生还原反应析出,所以铜离子浓度降低,故B正确;
C.粗铜中含有铁、镍等活泼性强于铜的金属,先于铜放电,所以若电路中通过1 mol电子,有小于0.5 mol铜被氧化,故C错误;
D.阴极上溶液中的铜离子得到电子发生还原反应,电极反应式为:Cu2++2e-→Cu,故D正确;
故选:C.
点评 本题考查了电解法精炼铜,熟悉电解池工作原理是解题关键,注意阳极放电顺序,题目难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
5.将一定质量的Mg、Cu组成的混合物投入适量稀硝酸中,固体恰好完全溶解时收集到标准状况下0.896LNO气体,向反应后溶液中加入2mol/L NaOH溶液70mL时金属离子恰好沉淀完全.则整个过程消耗的硝酸的物质的量为( )
| A. | 0.18mol | B. | 0.16mol | C. | 0.14mol | D. | 0.12mol |
10.最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的不正确叙述是( )
| A. | 14C与12C60中碳原子化学性质相同 | B. | 14C与14N的质量数相同 | ||
| C. | 14C是12C60的同素异形体 | D. | 14C与12C、13C互为同位素 |
4.95%的乙醇(密度为0.78g/cm3)用等体积的蒸馏水稀释后,所得溶液中乙醇的质量分数约为( )
| A. | 42% | B. | 48% | C. | 51% | D. | 65% |
5. 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | 常见的Y的氢化物具有正四面体结构 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
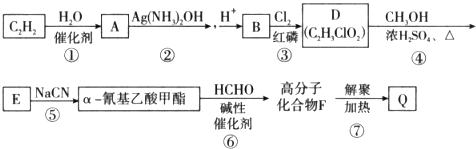
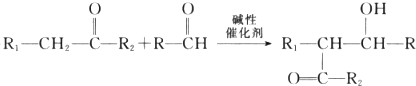
 不稳定,很快分子间脱水进行聚合,[R、R1和R2可表示氢原子、烃基、-OCH3、-CN(氰基)等基团]
不稳定,很快分子间脱水进行聚合,[R、R1和R2可表示氢原子、烃基、-OCH3、-CN(氰基)等基团] .
.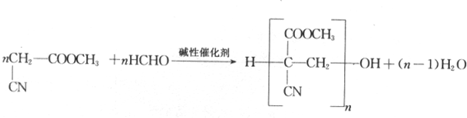 .
.
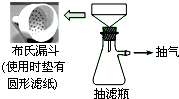 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.