题目内容
11.设阿伏加德罗常数为NA,下列说法正确的是( )| A. | 4.4g乙醛分子中含有的共用电子对数为0.6NA | |
| B. | 标准状况下,11.2L二氯甲烷所含分子数为0.5NA | |
| C. | 15.6g苯中含有碳碳双键的个数为0.6NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
分析 A.根据乙醛的结构判断,乙醛分子中含有的共用电子对数为7对;
B.气体摩尔体积适用对象为气体;
C.苯分子中不含有碳碳双键;
D.乙烯、丙烯(C3H6)、丁烯(C4H8)的最简式相同,混合物的最简式为CH2,据此计算.
解答 解:A.4.4 g乙醛的物质的量是1mol,含有的共用电子对数为0.7NA,故A错误;
B.标况下二氯甲烷为液体,不能使用气体摩尔体积,故B错误;
C.苯分子中不含有碳碳双键,故C错误;
D.混合物的最简式为CH2,使用含有的原子数为$\frac{14g}{14g/mol}$×3×NAmol-=3NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积适用的对象和条件是解题关键,题目难度不大.

练习册系列答案
相关题目
1.生活中遇到的某些问题,常常涉及于化学知识.下列各项叙述不正确的是( )
| A. | 鱼虾为了能长时间放置而不变质可以用适量福尔马林溶液浸泡 | |
| B. | “酸可除锈”是发生了化学变化,“洗涤剂可去油”是发生了物理变化 | |
| C. | 蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 煤酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒 |
2.针对节能减排,某化学学习研究性小组提出如下方案,你认为不够科学合理的是( )
| A. | 采用电解水法制取无污染的氢能 | B. | 完善煤液化制取汽油的技术 | ||
| C. | 研制推广以甲醇为燃料的汽车 | D. | 进一步提高石油加工工艺 |
16.把质量为m g的铜丝灼烧变黑,立即放入下列物质中,使铜丝变红,而且质量仍为m g的是( )
| A. | H2SO4 | B. | C2H5OH | C. | 稀HNO3 | D. | NaOH溶液 |
1.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | 氨气的相对分子质量大于甲烷 |
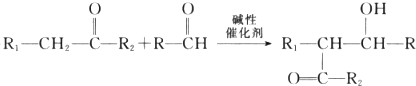
 不稳定,很快分子间脱水进行聚合,[R、R1和R2可表示氢原子、烃基、-OCH3、-CN(氰基)等基团]
不稳定,很快分子间脱水进行聚合,[R、R1和R2可表示氢原子、烃基、-OCH3、-CN(氰基)等基团] .
.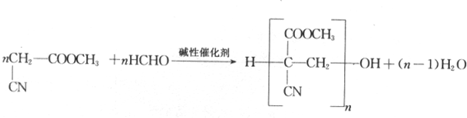 .
.