题目内容
6.将体积比1:4的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )| A. | 产物中只有四氯化碳分子是正四面体结构 | |
| B. | 瓶中气体的黄绿色逐渐变浅,瓶内壁有油状液滴形成 | |
| C. | 若日光直射,可能发生爆炸 | |
| D. | 生成物只有CCl4、HCl |
分析 A.根据价层电子对互斥理论确定其空间构型;
B.甲烷与氯气反应消耗氯气,反应生成二氯甲烷、三氯甲烷、四氯化碳;
C.若日光直射,气体剧烈膨胀,可能发生爆炸;
D.甲烷与氯气反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢.
解答 解:A.根据价层电子对互斥理论知,四氯化碳分子中碳原子含有4个共价单键,且不含孤电子对,所以为正四面体结构,故A正确;
B.甲烷与氯气反应消耗氯气,所以颜色变浅,反应生成二氯甲烷、三氯甲烷、四氯化碳都是油状液体,故B正确;
C.若日光直射,气体剧烈膨胀,可能发生爆炸,故C正确;
D.甲烷与氯气反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,故D错误;
故选:D.
点评 本题考查了甲烷与氯气的反应,熟悉取代反应条件及特点是解题关键,题目不难.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
16.下列说法正确的是( )
| A. | 乙烯和聚乙烯都能与水发生加成反应 | |
| B. | 实验室制溴苯时选用的试剂可以是溴水、苯和铁屑 | |
| C. | 配制银氨溶液时,将氨水逐滴加到 AgNO3溶液中,边加边振荡,直至沉淀恰好完全消失 | |
| D. | 银镜反应实验后试管内壁附有银,可用稀硫酸清洗 |
17.四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8.下列说法不正确的是( )
| A. | 与W相邻的同主族元素可制成重要的半导体材料 | |
| B. | 元素的原子半径从大到小的顺序是X、Y、Z | |
| C. | WZ4分子中W、Z 原子最外层均达到8电子结构 | |
| D. | W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
14.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
1.(1)在配合物[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是Fe3+,画出配合物离子[Cu(NH3)4]2+中的配位键 .
.
(2)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子CH4或CF4,三角锥形分子NH3或NF3,V形分子H2O.
(3)按要求填写下表中有序号的空格:
 .
.(2)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子CH4或CF4,三角锥形分子NH3或NF3,V形分子H2O.
(3)按要求填写下表中有序号的空格:
| 元素符号 | 电子排布式 | 价层电子排布 | 在周期表中的位置 |
| ① | 1s22s22p6 | ② | ③ |
| Cr | ④ | ⑤ | ⑥ |
18.关于元素周期表,下列叙述中不正确的是( )
| A. | IA族元素称为碱金属元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| D. | 地球上元素的分布和它们在元素周期表中的位置有密切关系 |
15.下列关于图所示原电池装置的叙述中,正确的是( )


| A. | 铜片是负极 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 有6.02×1022个电子经过导线时,锌片质量减少3.25g |
16.下列各项表达中正确的是( )
| A. | 聚丙烯的结构简式: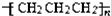 | B. | 乙醇的结构简式:CH3CH2OH | ||
| C. | 四氯化碳的电子式: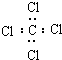 | D. | -CH3(甲基)的电子式为 |
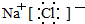 .
.