题目内容
2.对于第二周期从左到右的主族元素,下列说法中不正确的是( )| A. | 原子半径逐渐减小 | B. | 最外层电子数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐增强 |
分析 同一周期元素,从左到右,
A.原子半径随着原子序数增大而减小;
B.最外层电子数随着原子序数增大而增大;
C.元素最高化合价与其族序数相等,但O、F元素除外;
D.元素的非金属性元素原子序数增大而增强.
解答 解:同一周期元素,从左到右,
A.随着原子序数增大,原子核对最外层电子吸引力增大,所以原子半径随着原子序数增大而减小,故A正确;
B.原子最外层电子数与其族序数相等,所以最外层电子数随着原子序数增大而增大,故B正确;
C.元素最高化合价与其族序数相等,但O、F元素除外,O、F元素没有正化合价,故C错误;
D.元素随着原子序数增大其得电子能力增强,所以元素的非金属性元素原子序数增大而增强,故D正确;
故选C.
点评 本题考查同一周期元素原子结构和元素性质递变规律,为高频考点,侧重考查元素周期律综合应用,注意O、F元素没有正化合价,为易错点.

练习册系列答案
相关题目
12.下列分子中各原子都满足8e-结构的是( )
| A. | SO2 | B. | CH4 | C. | PCl3 | D. | PCl5 |
13.下列说法正确的是( )
| A. | 汽油和花生油都可发生皂化反应 | |
| B. | 蚕丝、棉、麻、的主要成分都是纤维素 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 加热马铃薯可使其中的淀粉变成葡萄糖 |
10.下列反应的离子方程式正确的是( )
| A. | 金属铝溶于稀硝酸中:2Al+6H+=2A13++3H2↑ | |
| B. | 碳酸钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| C. | 碳酸氢钠溶液与少量盐酸反应:CO32-+2 H+=H2O+CO2↑ | |
| D. | 碳酸钠溶液缓慢滴入少量稀盐酸:CO32-+H+=HCO3- |
17.四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8.下列说法不正确的是( )
| A. | 与W相邻的同主族元素可制成重要的半导体材料 | |
| B. | 元素的原子半径从大到小的顺序是X、Y、Z | |
| C. | WZ4分子中W、Z 原子最外层均达到8电子结构 | |
| D. | W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
7.下列措施中,能减慢化学反应速率的是( )
| A. | 将块状固体药品研细后再反应 | |
| B. | 将H2O2溶液存放在低温冷暗处 | |
| C. | 用FeCl3溶液作H2O2分解反应的催化剂 | |
| D. | 用2 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
14.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
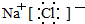 .
. 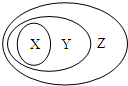 用图表示的一些物质或概念间的从属关系中错误的是( )
用图表示的一些物质或概念间的从属关系中错误的是( )