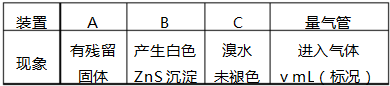
题目内容
3.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题: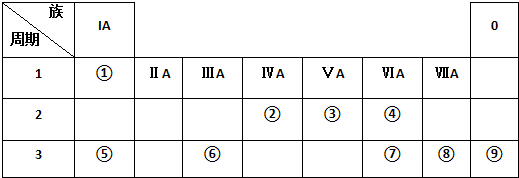
(1)④、⑤的简单离子,其半径更大的是O2-(写离子符号).
(2)⑦、⑧的气态氢化物,更稳定的是HCl(填化学式)
(3)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为HNO3+NH3=NH4NO3,产物中化学键的类型为共价键、离子键.
分析 由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)同周期自左而右元素非金属性增强,其氢化物稳定性增强;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸;上述元素中Na的金属性最强,故氢氧化钠碱性最强,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(4)氨气与硝酸反应生成硝酸铵,硝酸铵为离子化合物,据此解答即可.
解答 解:由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+,故答案为:O2-;
(2)同周期自左而右元素非金属性增强,故非金属性Cl>S,非金属性越强,其氢化物稳定性越稳定,故氢化物稳定性:HCl>H2S,故答案为:HCl;
(3)最高价氧化物的水化物中,酸性最强的是高氯酸,化学式为HClO4;上述元素中Na的金属性最强,故氢氧化钠碱性最强,化学式为NaOH,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:HClO4;NaOH;Al(OH)3+OH-=AlO2-+2H2O;
(4)氨气与硝酸反应生成硝酸铵,化学反应方程式为:HNO3+NH3=NH4NO3,硝酸铵中含有N-H共价键、铵根与硝酸根之间的离子键,故答案为:HNO3+NH3=NH4NO3;共价键、离子键.
点评 本题考查元素周期表与元素周期律,比较基础,注意掌握微粒半径比较与金属性、非金属性强弱比较.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 汽油和花生油都可发生皂化反应 | |
| B. | 蚕丝、棉、麻、的主要成分都是纤维素 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 加热马铃薯可使其中的淀粉变成葡萄糖 |
14.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
18.关于元素周期表,下列叙述中不正确的是( )
| A. | IA族元素称为碱金属元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| D. | 地球上元素的分布和它们在元素周期表中的位置有密切关系 |
8.下列叙述中正确的是( )
| A. | 金属晶体的熔点和沸点都很高 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
15.下列关于图所示原电池装置的叙述中,正确的是( )


| A. | 铜片是负极 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 有6.02×1022个电子经过导线时,锌片质量减少3.25g |
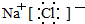 .
. 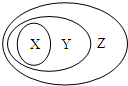 用图表示的一些物质或概念间的从属关系中错误的是( )
用图表示的一些物质或概念间的从属关系中错误的是( )