题目内容
【题目】(一)铅蓄电池是典型的二次电池,电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________________________。当外电路通过1 mol电子时,理论上负极板的质量增加______g。
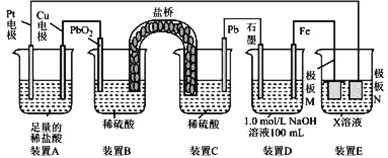
(二)某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若用HNO3(浓)作电解质溶液,电极为铜片和铝片,正极上发生的电极反应式为________________;
(2)若电解质溶液为0.5mol/LNaOH溶液,电极为镁片和铝片,则负极的电极反应式为____________。
【答案】PbO2+2e-+4H++SO42-=PbSO4+2H2O 48 NO3-+e-+2H+=NO2↑+H2O Al-3e- +4OH- =[Al(OH)4]-
【解析】
(一)该铅蓄电池中放电时,正极反应式为PbO2+2e-+SO42-+4H+=PbSO4(s)+2H2O、负极反应式为Pb-2e-+SO42-=PbSO4;据此分析解答;
(二)(1)在浓硝酸中,铝遇浓硝酸发生钝化,铜溶解,所以铜易失电子为负极,铝是正极;
(2)在氢氧化钠溶液中镁不失去电子,而铝失去电子作负极,镁作正极。
(一)该铅蓄电池中放电时,正极反应式为PbO2+2e-+SO42-+4H+=PbSO4(s)+2H2O、负极反应式为Pb(s)-2e-+SO42-(aq)=PbSO4(s),2e-~Pb~PbSO4~△m=96g ,因此当外电路通过1 mol电子时,理论上负极板的质量增加96g×![]() =48g;
=48g;
答案:PbO2+2e-+4H++SO42-=PbSO4+2H2O;48;
(二)(1)该原电池中,铝和浓硝酸发生钝化现象而阻止进一步反应,铜和浓硝酸反应,所以铜失电子而作负极,铝作正极,铜电极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,正极上硝酸根离子得电子生成二氧化氮,电极反应式为:NO3-+e-+2H+=NO2↑+H2O;
答案:NO3-+e-+2H+=NO2↑+H2O;
(2)该原电池中,铝易失电子而作负极,镁作正极,正极上水得电子生成氢氧根离子和氢气,电极反应式为:2H2O+2e-=2OH-+H2↑,负极上铝失电子生成[Al(OH)4]-,电极反应式为Al-3e- +4OH- =[Al(OH)4]-;
答案:Al-3e- +4OH- =[Al(OH)4]-。

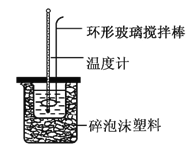
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是__________。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=__[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_______(填“偏大”、“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是_________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大