题目内容
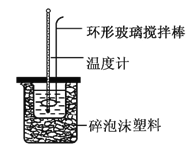
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是__________。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=__[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_______(填“偏大”、“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是_________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
【答案】Cu传热快,热量损失大 提高装置的保温效果 -56.8 kJ·mol-1 偏大 ABE
【解析】
(1)铜是金属,是热的良导体,传热快,热量损失大,因此实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒。
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果,尽可能减少热量损失。
(3)根据表中数据可知三次实验中温度差分别是23.7℃—(20.2℃+20.3℃)÷2=3.45℃、23.8℃—(20.5℃+20.3℃)÷2=3.4℃、24.9℃—(21.5℃+21.6℃)÷2=3.35℃,所以三次实验的平均值是3.4℃,则反应中放出的热量=100g×4.18 J·(g·℃)-1×3.4℃=1421.2J=1.4212kJ。又因为反应中生成水的物质的量是0.025mol,则该反应的中和热ΔH=—1.4212kJ÷0.025mol=-56.8 kJ/mol。由于氢氧化钠固体溶于水放热,则如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏大。
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,则称量氢氧化钠溶液的温度时起始温度偏高,则测量值偏低,A正确;B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓会导致热量损失,则测量值偏低,B正确;C.做本实验的当天室温较高对实验没有影响,C错误;D.在量取盐酸时仰视读数,则读数偏高,则放出放热热量增加,测量值偏高,D错误;E.大烧杯的盖板中间小孔太大会导致热量损失,则测量值偏低,E正确,答案选ABE。