题目内容
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4xH2O)的工艺流程如下:
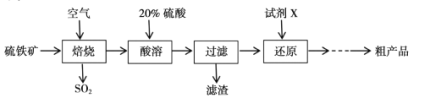
(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____。
(2)写出酸溶过程主要反应的离子方程式____。
(3)试剂X是(写化学式)____。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4xH2O)的操作是____
(5)利用如图装置测定FeSO4xH2O中结晶水含量:
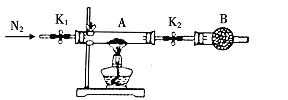
实验前通入N2,的主要目的是____,装置B中盛放的试剂是____。
【答案】4FeS2+11O2![]() 2Fe2O3+8SO2 Fe2O3+6H+=2Fe3++3H2O Fe 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 排出装置的氧气,可避免硫酸亚铁被氧化 碱石灰
2Fe2O3+8SO2 Fe2O3+6H+=2Fe3++3H2O Fe 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 排出装置的氧气,可避免硫酸亚铁被氧化 碱石灰
【解析】
(1)焙烧过程是硫化亚铁与氧气的反应,生成三氧化二铁和二氧化硫;
(2)酸溶是三氧化二铁与硫酸的反应;
(3)试剂X是还原剂,其作用是将Fe3+还原为Fe2+,为避免引入新的杂质,X是铁粉;
(4)溶液中获得硫酸亚铁晶体(FeSO4xH2O)的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)硫酸亚铁易被氧化,通入氮气排出装置的氧气,干燥管中加入碱石灰可避免空气的水进入A装置。
(1)高温条件下FeS2与氧气反应生成Fe2O3与SO2,该反应的化学方程式为:4FeS2+11O2![]() 2 Fe2O3+8SO2;
2 Fe2O3+8SO2;
(2)酸溶是三氧化二铁与硫酸反应的过程,化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子方程式为Fe2O3+6H+=2Fe3++3H2O;
(3)试剂X是还原剂,其作用是将Fe3+还原为Fe2+,为避免引入新的杂质,X是铁粉;
(4)还原得到的溶液的主要溶质是FeSO4,从中获得硫酸亚铁晶体(FeSO4xH2O)的操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)FeSO4xH2O加热分解可以得到硫酸亚铁和水,由于亚铁离子不稳定,易被氧气氧化,故实验前需赶走空气,B中应该盛放干燥剂碱石灰,防止空气和水蒸气进入,使亚铁离子被氧化,或者防止亚铁离子水解。

【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
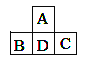
【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。