题目内容
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
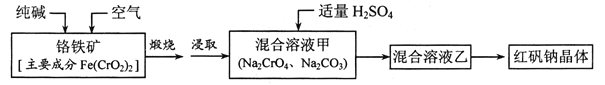
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________Fe(CrO2)2+Na2CO3+O2![]() Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
【答案】1s22s22p63s23p63d3或[Ar] 3d3 4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2 2 CrO42-+2H+
2Fe2O3+8Na2CrO4+8CO2 2 CrO42-+2H+![]() Cr2O72-+H2O、CO32-+2H+==CO2↑+H2O Fe-2e-==Fe2+ 阴极区水电离出的H+得电子产生H2,促进水的电离平衡正向移动,使溶液OH-浓度增大 16.8
Cr2O72-+H2O、CO32-+2H+==CO2↑+H2O Fe-2e-==Fe2+ 阴极区水电离出的H+得电子产生H2,促进水的电离平衡正向移动,使溶液OH-浓度增大 16.8
【解析】
(1)Cr为24号元素,位于周期表中第四周期VIB族;
(2)利用化合价升降法配平;
(3)加入硫酸时,碳酸钠与硫酸反应生成硫酸钠、二氧化碳和水,铬酸根在酸性环境下可以变成重铬酸根,黄色溶液逐渐变成橙色;
(4)①铁作阳极时,铁失电子生成亚铁离子;
②阴极为水得电子生成氢气和氢氧根离子,破坏水的电离平衡;
③根据6Fe2++Cr2O72-+14H+=6Fe3++ 2Cr3++7H2O计算。
(1)Cr为24号元素,位于周期表中第四周期VIB族,基态电子排布式为1s22s22p63s23p63d3或[Ar]3d3;
(2)反应中,Fe化合价由+2变为+3价,Cr由+3价变为+6价,1molFe(CrO2)2失去7mol电子,O2化合价由0价变为-2价,1molO2得到4mol电子,最小公倍数为28,则方程式为4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4+8CO2;
2Fe2O3+8Na2CrO4+8CO2;
(3)加入硫酸时,碳酸钠与硫酸反应生成硫酸钠、二氧化碳和水,铬酸根在酸性环境下可以变成重铬酸根,黄色溶液逐渐变成橙色,则反应的离子方程式为2 CrO42-+2H+![]() Cr2O72-+H2O、CO32-+2H+==CO2↑+H2O;
Cr2O72-+H2O、CO32-+2H+==CO2↑+H2O;
(4)①铁作阳极时,铁失电子生成亚铁离子,电极反应式为Fe-2e-==Fe2+;
②阴极为水得电子生成氢气和氢氧根离子,反应式为2H2O-2e-=H2↑+2OH-,破坏水的电离平衡,溶液中氢离子浓度减小,OH-浓度增大;
③阳极产生的亚铁离子与Cr2O72-反应生成铁离子、铬离子,n(Fe2+):n(Cr2O72-)=6:1,溶液中减少m(Cr3+)=100×103L×(52.5mg/L-0.5mg/L)10-3g/mg =5200g,减少Cr元素的质量=5200g/52g/mol=100mol,则n(Fe2+)=300mol,消耗铁的质量为300mol![]() 56g/mol=16800g=1.68kg。
56g/mol=16800g=1.68kg。

【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D
【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。