题目内容
【题目】下列对应的离子方程式正确的是( )
A.酸性高锰酸钾溶液和草酸溶液反应:2![]() +16H++5
+16H++5![]() ═2Mn2++10CO2↑+8H2O
═2Mn2++10CO2↑+8H2O
B.向氯化铁溶液中通入过量二氧化硫:2Fe3++3SO2+6H2O═2Fe+3![]() +12H+
+12H+
C.银和稀硝酸反应:3Ag+4H++![]() ═3Ag++2H2O+NO↑
═3Ag++2H2O+NO↑
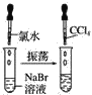
D.向氯水中加入碳酸钠:Cl2+![]() ═Cl-+ClO-+CO2↑
═Cl-+ClO-+CO2↑
【答案】C
【解析】
A.草酸是弱酸,酸性高锰酸钾溶液和草酸溶液反应:2![]() +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故A错误;
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故A错误;
B.向氯化铁溶液中通入过量二氧化硫生成氯化亚铁:2Fe3++SO2+2H2O═2Fe2++![]() +4H+,故B错误;
+4H+,故B错误;
C.银和稀硝酸反应生成硝酸银、水和NO:3Ag+4H++![]() ═3Ag++2H2O+NO↑,故C正确;
═3Ag++2H2O+NO↑,故C正确;
D.氯气溶于水生成盐酸和次氯酸,盐酸属于强酸,HClO属于弱酸,酸性H2CO3>HClO>![]() ,氯水中加入少量碳酸钠的离子方程式为2Cl2+
,氯水中加入少量碳酸钠的离子方程式为2Cl2+![]() +H2O=CO2↑+2Cl-+2HClO,氯水中加入足量碳酸钠的离子方程式为:Cl2+2
+H2O=CO2↑+2Cl-+2HClO,氯水中加入足量碳酸钠的离子方程式为:Cl2+2![]() +H2O=Cl-+ClO-+2
+H2O=Cl-+ClO-+2![]() ,故D错误;
,故D错误;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
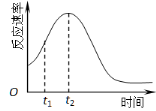 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
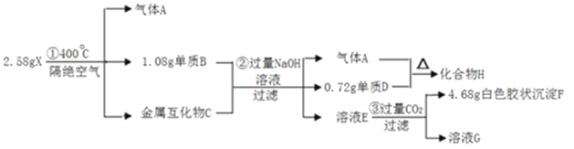
【题目】下表中各组物质不能实现如图所示转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | AlCl3 | Al | Al(OH)3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
A.AB.BC.CD.D