题目内容
【题目】认真观察下列装置,下列说法错误的是
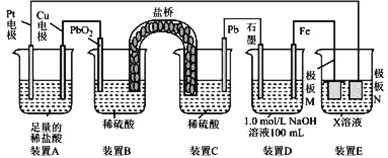
A.盐桥中的阳离子向装置B移动
B.装置A中总反应的离子方程式为 Cu+2H+ ![]() Cu2++H2 ↑
Cu2++H2 ↑
C.若在装置 D 中生成 0. 2 mol Fe(OH)3,则消耗水的物质的量共为0. 5mol
D.若装置E的目的是在Cu材料上镀银,则极板 N 的材料为Cu
【答案】D
【解析】
A.装置B和装置C形成原电池,铅作负极,失电子结合硫酸根离子生成硫酸铅,二氧化铅作正极,正极上二氧化铅得电子结合硫酸根离子生成硫酸铅,盐桥中的阳离子移动到正极B,故A正确;
B.A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,总电极反应式为Cu+2H+ ![]() Cu2++H2 ↑,故B正确;
Cu2++H2 ↑,故B正确;
C.装置D的总电极反应为Fe+2H2O![]() Fe(OH)2+H2 ↑,后续反应为4 Fe(OH)2+O2+2H2O=4 Fe(OH)3,生成 0. 2 mol Fe(OH)3消耗水的物质的量为0.2×2+0.1=0.5mol,故C正确;
Fe(OH)2+H2 ↑,后续反应为4 Fe(OH)2+O2+2H2O=4 Fe(OH)3,生成 0. 2 mol Fe(OH)3消耗水的物质的量为0.2×2+0.1=0.5mol,故C正确;
D.装置E电镀时N为阳极,镀层作阳极,材料为银;M为阴极,镀件作阴极,材料为Cu,故D错误;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。